Reações redox
IFSP - Cursinho Popular
Como citar este documento: MONTEIRO, Wallasse G. Romão. Reações redox. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/ cursinho/home/materias/reacoes-redox.html. Acesso em: [data de acesso].
Introdução
Você já parou para se perguntar por que alguns materiais de ferro ficam enferrujados com o passar do tempo? A ferrugem (figura 1) é uma reação de oxidação do metal, neste caso, o ferro. Por ficar exposto ao ar livre, o oxigênio do meio reage com o ferro, oxidando-o. Tal reação tem como produto o óxido de ferro, que é o que chamamos de ferrugem (figura 1) no próximo link. Isso pode ser evitado com a pintura dos metais com tintas especiais, que atuam como um recobrimento protetor, evitando o contato do ferro com o oxigênio do ar.
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Oxirredução ou Redox
Como citar este documento: MONTEIRO, Wallasse G. Romão. Reações redox. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/ cursinho/home/materias/reacoes-redox.html. Acesso em: [data de acesso].
Figura 1 - Vagões de um trem sendo deteriorados por ferrugem

Fonte: Wikimedia Commons (2008) (https://commons.wikimedia.org/wiki/File:Rust.rost.JPG)
Uma reação de oxirredução, ou redox, como é chamada, ocorre quando há transferências de elétrons entre as espécies químicas envolvidas. É possível perceber se uma determinada reação é de oxirredução analisando o que chamamos de número de oxidação (NOx) que cada elemento possui, que representa uma carga imaginária do elemento caso as ligações entre os átomos fossem totalmente iônicas.
Para efetivamente determinarmos se houve uma reação com transferência de elétrons, devemos analisar o NOx dos elementos envolvidos nos dois lados da reação. Se percebermos que uma espécie química perdeu elétrons, dizemos que ela foi oxidada. Caso contrário, se percebermos que uma espécie química ganhou elétrons, dizemos que ela foi reduzida.
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Número de oxidação NOx
Como citar este documento: MONTEIRO, Wallasse G. Romão. Reações redox. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/ cursinho/home/materias/reacoes-redox.html. Acesso em: [data de acesso].
O NOx é definido como uma carga real (no caso de íons) ou aparente (para moléculas) com base em suas eletronegatividade. Abaixo, está listado os números mais comuns que aparecem, que podem nos auxiliar para determinarmos o NOx dos elementos envolvidos na reação:
- Um átomo de um elemento livre tem um número de oxidação igual a 0. Por exemplo, Cl, O2, S, H2, etc.
- Um íon monoatômico tem um número de oxidação igual à sua carga. Por exemplo, o NOx do Na+ é +1, Cl- é -1, do Fe2+ é +2 e assim por diante.
- Os metais da família 1A combinados com outros elementos sempre têm um número de oxidação igual a +1, enquanto os metais da família 2A sempre têm um número de oxidação de +2.
- O NOx do flúor é de -1 em todos os compostos.
- O hidrogênio tem um número de oxidação de +1 na maioria dos compostos. Porém, quando combinados a metais como sódio e potássio por exemplo, seu NOx é -1
- O oxigênio tem um número de oxidação de -2. A principal exceção é em peróxidos, em que o oxigênio tem um número de oxidação de -1. Exemplos: Li2O2, Na2O2, K2O2, H2O2.
- Cloro, Bromo e Iodo têm um número de oxidação de -1, a menos que combinados com o Oxigênio ou o Flúor.
- A soma dos números de oxidação para todos os átomos em um composto neutro é igual a zero, enquanto a soma de todos os átomos em um íon poliatômico é igual à carga do íon. Portanto, ao fazermos o somatório do NOx dos átomos do composto analisado a carga total deve ser igual a carga da espécie química.
Vamos determinar o NOx de alguns compostos:
Exemplo 1:
HNO3
Como Oxigênio tem carga -2 e Hidrogênio carga + 1, devemos então descobrir a carga do Nitrogênio. Observe também que possuímos 3 átomos de Oxigênio na molécula, e que a soma de todas as cargas deve ser 0.
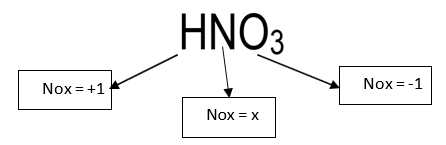
Podemos montar uma equação, sendo x a carga do Nitrogênio:
1+x+3*(-2) = 0
x = +5
Exemplo 2:
H2SO4
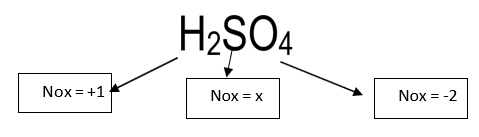
Novamente, podemos montar uma equação
2*(1)+x+4*(-2)=0
x= +6 (NOx do Enxofre)
Exemplo 3:
MnO4-
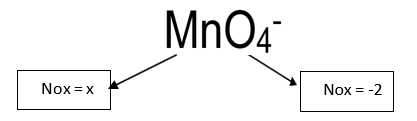
x = +7 (NOx do Manganês)
Exemplo 4:
H2S
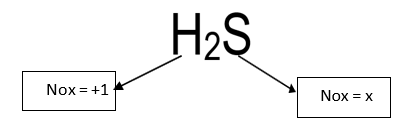
x=+2 (NOx do Enxofre)
Exemplo 5:
CrO42-
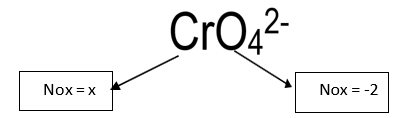
x= +6 (NOx do Cromo)
Exemplo 6:
NO2
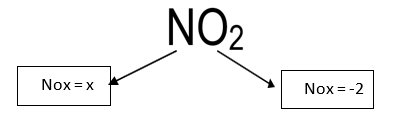
x=+4 (NOx do Nitrogênio)
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Identificando agente oxidante e agente redutor
Como citar este documento: MONTEIRO, Wallasse G. Romão. Reações redox. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/ cursinho/home/materias/reacoes-redox.html. Acesso em: [data de acesso].
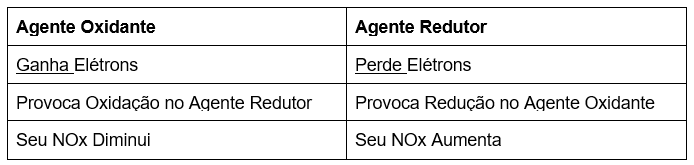
Uma das características essenciais que distinguem uma reação de oxirredução das demais é a presença de um agente oxidante e de um agente redutor, que podem ser definidos de acordo com a tabela abaixo:
Em uma reação de oxirredução, a espécie química oxidada é o agente redutor, já a espécie química reduzida é o agente oxidante.
Exemplo 1
Vamos identificar o agente redutor e oxidante da seguinte reação:
Fe2O3 (s) + 3 CO (g) → Fe2 (s) + 3 CO2 (g)
Vamos identificar o NOx dos elementos nos dois lados da equação.
Sabemos que o NOx do carbono é -2, portanto podemos montar uma equação para determinar o NOx dos demais componentes:
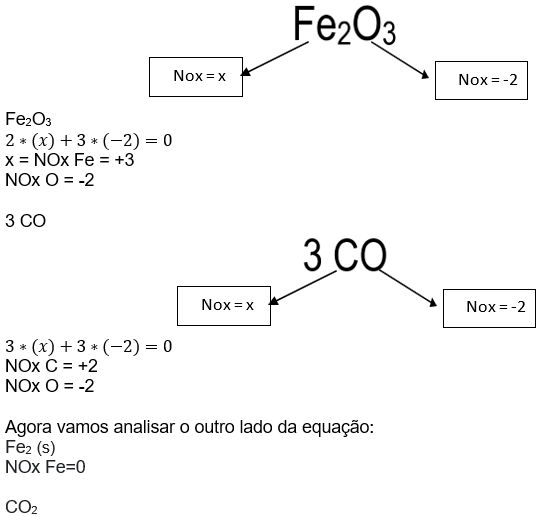
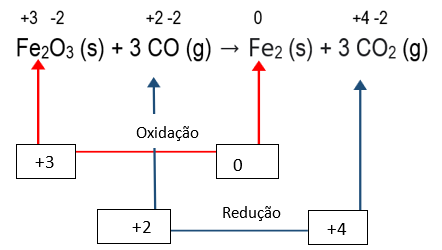
Analisando a variação do ![]() é possível observar que os átomos de ferro ganham 3 elétrons, passando de um NOx de +3 para 0, e cada átomo de carbono perde 2 elétrons, passando de um NOx +2 para um NOx +4.
é possível observar que os átomos de ferro ganham 3 elétrons, passando de um NOx de +3 para 0, e cada átomo de carbono perde 2 elétrons, passando de um NOx +2 para um NOx +4.
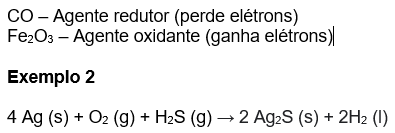
Vamos identificar o NOx dos elementos nos dois lados da equação.
Pelas diretrizes, sabemos que o NOx do Ag e do O2 é igual a zero.
Sabemos também que o NOx do hidrogênio é +1, portanto podemos montar uma equação para determinar o NOx dos demais componentes:

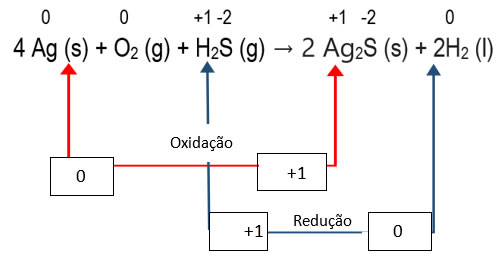
Analisando a variação de NOx, é possível observar que cada átomo de hidrogênio ganha um elétron, passando de um NOx +1 para um NOx=0 e que cada átomo de prata, Ag, perde um elétron, passando de um NOx=0 para um NOx +1. Assim, concluímos que:
Agente oxidante: H2S (sofre redução)
Agente redutor: Ag (sofre oxidação)
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Balanceamento de equações redox
Como citar este documento: MONTEIRO, Wallasse G. Romão. Reações redox. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/ cursinho/home/materias/reacoes-redox.html. Acesso em: [data de acesso].
Em casos mais simples como os demonstrados a seguir, podemos usar etapas simples para fazer o balanceamento de equações.
Passo 1: identificar as espécies oxidadas e reduzidas
Exemplo 1
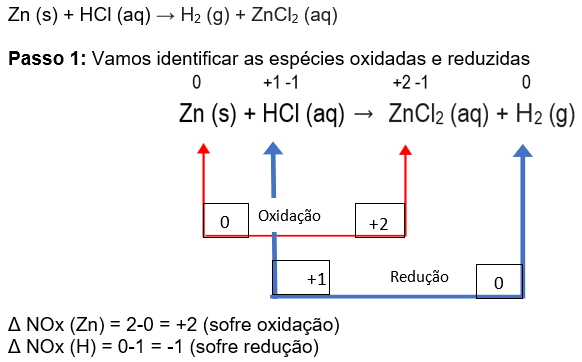
Passo 2: Vamos pegar, entre as espécies oxidadas e reduzidas aquela que possui maior atomicidade, e sem NOx repetido e colocar na tabela:
Neste caso, na parte oxidada peguei o ZnCl2 que possui atomicidade 1 (só tem 1 átomo de zinco na espécie) e seu NOx não está repetido. Eu poderia ter pegado o Zn (s) também, uma vez que ele também possui atomicidade 1 e seu NOx não é repetido, e isso não afetaria os resultados.

Observação: devemos sempre simplificar os valores que obtivermos. Neste exemplo, encontramos um valor de 2 em cima e 2 embaixo. Portanto simplificamos para 1 e 1.
Agora devemos multiplicar "cruzado", ou seja, pegamos o valor que encontramos na parte de cima e multiplicamos pelo ZnCl2, e o número que encontramos na parte de baixo multiplicamos pelo H2.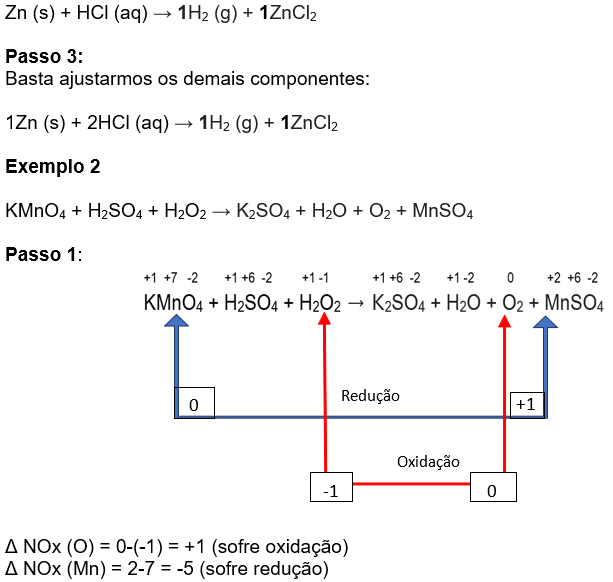
Passo 2:
Vamos pegar, entre as espécies oxidadas e reduzidas aquela que possui maior atomicidade, e sem NOx repetido e colocar na tabela:
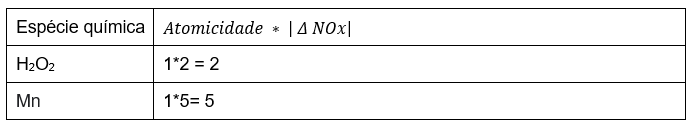
Passo 2:
Vamos pegar, entre as espécies oxidadas e reduzidas aquela que possui maior atomicidade, e sem NOx repetido e colocar na tabela:

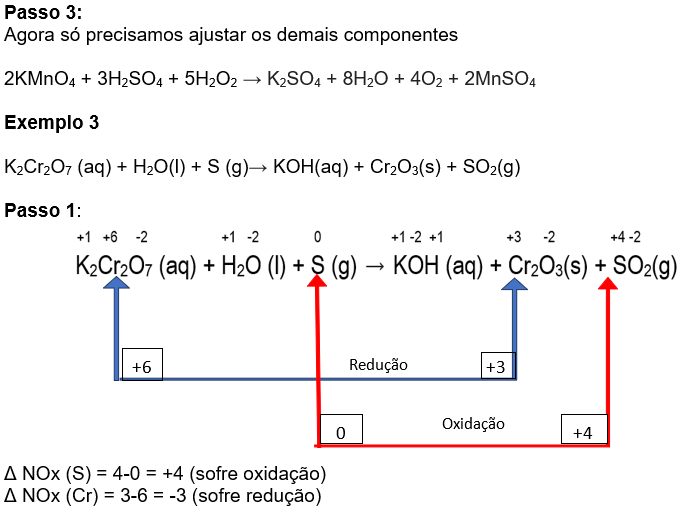
Agora multiplicamos a espécie química que está na parte de cima da tabela pela quantidade de elétrons que encontramos em baixo e vice-versa:
2K2Cr2O7 (aq) + H2O (l) + 3S (g) → KOH (aq) + Cr2O3(s) + SO2(g)
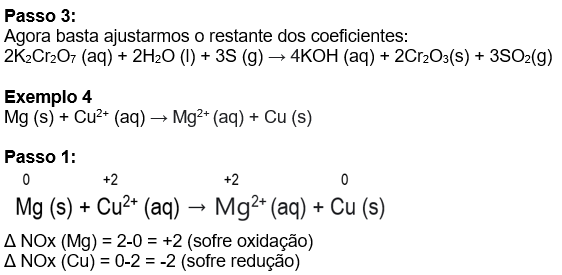

Esse procedimento que vimos resolverá boa parte dos nossos problemas de
Em toda reação química o número de elétrons é conservado, pois não são criados e nem destruídos. Portanto, o número de elétrons cedidos pelo agente é recebido em igual quantidade pelo agente oxidante.
Essa informação é de grande utilidade, pois existem muitas reações químicas que são difíceis de balancear pelo método que usamos nos exemplos anteriores, e separá- las em semi- reações será bastante útil.
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Semi-reações
Como citar este documento: MONTEIRO, Wallasse G. Romão. Reações redox. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/ cursinho/home/materias/reacoes-redox.html. Acesso em: [data de acesso].
Para mostrar a perda de elétrons de uma espécie química, utilizamos as chamadas semi- reações. Elas mostram as duas contribuições para a reação Redox- oxidação e redução.
Abaixo temos um exemplo de semi- reação de oxidação.
![]()
Uma semi- reação é uma maneira conceitual de descrever uma oxidação. Quando há a reação entre o Magnésio e o Oxigênio, por exemplo, o Magnésio é oxidado, os elétrons que são perdidos pelo Magnésio movem- se diretamente para átomos de Oxigênio das proximidades. Dessa forma, dizemos que a equação não descreve o estado dos elétrons, pois eles estão "em trânsito", e não tem um estado físico definido.
Abaixo temos um exemplo de reação de redução (ganho de elétrons).
![]()
Observe que o íon de Fe3+ ganha um elétron e passa a ser Fe2+. O par redox para este exemplo é Fe3+/Fe2+
Atkins (2001) descreve alguns passos que devemos seguir para chegar ao balanceamento de reações de oxirredução trabalhando com semi- reações:
Passo 1- identificar quem oxidou e quem reduziu.
Passo 2- escrever equações base para as semi- reações de oxidação e redução.
Passo 3- balancear os componentes das duas semi- reações com exceção de oxigênio e hidrogênio
Passo 4- em solução ácida balanceie O pelo uso de H2O; depois balancear o H usando H+. Em solução básica, balanceie O pelo uso de H2O; balancear então H pela adição de H2O do lado de cada semi reação onde h seja necessário, e adicionar OH no lado oposto
Quando adicionamos
OH ![]() H2O
H2O
Estamos efetivamente adicionando um átomo de H do lado direito
Quando adicionamos
H2O ![]() OH
OH
Estamos efetivamente adicionando um átomo de H do lado esquerdo. Observe que uma molécula de água é adicionada para cada átomo de hidrogênio necessário.
Passo 5- Balanceie as cargas elétricas pela adição de elétrons do lado esquerdo da reação de redução e do lado direito da reação de oxidação.
Passo 6 – Multiplique todas as espécies, em uma ou em ambas as semi- reações, pelo fator que resulte em número iguais de elétrons nas duas semi- reações, e então some – as.
Por fim, basta simplificar a equação eliminando espécies que aparecem em ambos os lados da equação e verificar se o balanceamento de cargas e átomos estão corretos.
Exemplo: balanceamento de equações em meio ácido.
![]()
Passo 1
Vamos analisar o NOx das espécies envolvidas para determinar a espécie oxidada e reduzida:

Passo 5
![]()
Observe que possuímos uma carga de -4 no lado esquerdo da flecha e uma carga de -1 do lado direito. As cargas elétricas devem estar em igualdade dos dois lados. Portanto devemos multiplicar OH- por 4:
![]()
Agora ajustamos os coeficientes estequiométricos da reação:
![]()
Passo 6
![]()
Como já discutimos o número de elétrons cedidos pelo agente redutor (espécie oxidada) é recebido em igual quantidade pelo agente oxidante (espécie reduzida). Assim devemos multiplicar a semi- reação de oixidação por 3 e a semi- reação de oxidação por 2, de forma que seja transferido 6 elétrons em cada:
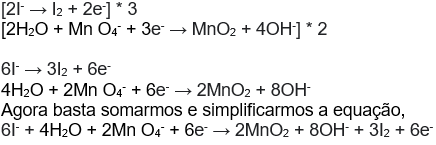
Podemos ainda simplificar a equação, eliminando termos iguais dos dois lados:
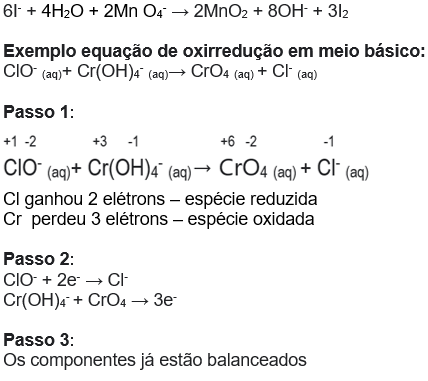
Passo 4:
Adiciono uma molécula de água do lado direito para equilibrar a quantidade de oxigênio:
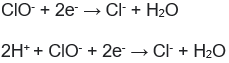
Passo 5:
Adiciono H+ para equilibrar as cargas nos dois lados da semi- reação
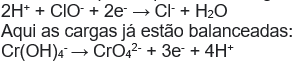
Passo 6:

Observe que sobrou 2H+, portanto devemos adicionar íons OH- para neutralizar esses prótons.
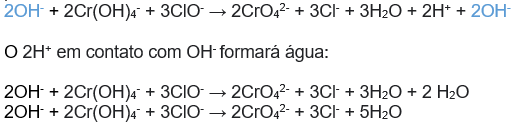
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Exercícios
Como citar este documento: MONTEIRO, Wallasse G. Romão. Reações redox. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/ cursinho/home/materias/reacoes-redox.html. Acesso em: [data de acesso].
1. (UFMG-MG) Considere as seguintes equações:
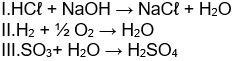
Ocorre oxirredução apenas em:
a) I.
b) II.
c) III.
d) I e III.
e) II e III
2. (Cesgranrio-RS) Observe a reação:
![]()
A partir dela, podemos afirmar corretamente que:
b) o Sn sofre oxidação, e o O, redução.
c) o Sn sofre oxidação, e HCl, redução.
d) a H2O2 sofre redução, e o Cl, oxidação.
e) a H2O2 sofre oxidação, e o Sn, redução.
3. (PUC-RS) Em relação à equação de oxidação - redução não balanceada Fe + CuSO4 ![]() Fe2(SO4)3 + Cu, pode-se afirmar que o:
Fe2(SO4)3 + Cu, pode-se afirmar que o:
a) número de oxidação do cobre no sulfato cúprico é +1.
b) átomo de ferro perde 2 elétrons.
c) cobre sofre oxidação.
d) ferro é agente oxidante.
e) ferro sofre oxidação.
4. (ITA-SP) Na reação iônica ![]()
a) o níquel é o oxidante porque ele é oxidado.
b) o níquel é o redutor porque ele é oxidado.
c) o íon cúprico é o oxidante porque ele é oxidado.
d) o íon cúprico é o redutor porque ele é reduzido.
e) não se trata de uma reação de redox, logo não há oxidante e nem redutor.
5. (ENEM-2019) Estudos mostram o desenvolvimento de biochips utilizados para auxiliar o diagnóstico de diabetes melito, doença evidenciada pelo excesso de glicose no organismo. O teste é simples e consiste em duas reações sequenciais na superfície do biochip, entre a amostra de soro sanguíneo do paciente, enzimas específicas e reagente (iodeto de potássio, KI), conforme mostrado na imagem.
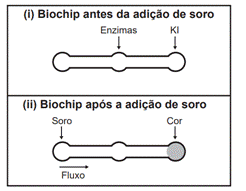
Após a adição de soro sanguíneo, o fluxo desloca-se espontaneamente da esquerda para a direita (ii) promovendo reações sequenciais, conforme as equações 1 e 2. Na primeira, há conversão de glicose do sangue em ácido glucônico, gerando peróxido de hidrogênio:

O tipo de reação que ocorre na superfície do biochip, nas duas reações do processo, é
a) Análise
b) Síntese
c) Oxirredução
d) Complexação
e) Ácido- base
6. (UFRRJ) Os talheres de prata têm um grande inconveniente: ficam escuros e perdem o brilho. Se os lavarmos em uma bacia que contenha metais menos nobres, escurecerão. Se entrarem em contato com ovos, perderão o brilho. E isto se dá porque os ovos são ricos em enxofre, o qual se liga à prata formando um composto insolúvel: o sulfeto de prata.
Na reação da prata com o enxofre, a prata:
a) sofre redução.b) recebe um elétron.
c) sofre oxidação.
d) passa de Ag+ para Ag 0.
e) faz ligação covalente com o enxofre.
7. (UFSC – SC) Os índices que ajustam corretamente as equações:
I. NaNO3 → NaNO2 + O2
II. Al + H2SO4 → Al2(SO4)3 + H2
são respectivamente:
a) I- 2, 2, 1 e II- 2, 3, 3, 2
b) I- 1, 2, 1 e II- 2, 3, 1, 3
c) I- 2, 2, 1 e II- 2, 3, 1, 3
d) I- 1, 2, 2 e II- 2, 3, 3, 2
8. (PUC - RJ) O óxido de alumínio (Al2O3) é utilizado como antiácido. A reação que ocorre no estômago é:
![]()
Os coeficientes x, y e w são, respectivamente:
a) 1, 2, 3, 6
b) 1, 6, 2, 3
c) 2, 3, 1, 6
d) 2, 4, 4, 3
e) 4, 2, 1, 6
9. (UFMG - MG) A equação ![]() não está balanceada. Balanceando-a com os menores números possíveis, a soma dos coeficientes estequiométricos será:
não está balanceada. Balanceando-a com os menores números possíveis, a soma dos coeficientes estequiométricos será:
a) 4
b) 7
c) 10
d) 11
e) 12
10. (UFSCar – SP) O ferro metálico, quando exposto ao ar por um longo tempo, "enferruja", ou seja, oxida-se, formando Fe2O3, de acordo com a equação química de óxido-redução: x Fe(s) + y O2(g) → z Fe2O3(s). Os valores de x, y e z são iguais, respectivamente, a:
a) 2, 3 e 3.
b) 2, 4 e 2.
c) 3, 5 e 3.
d) 4, 3 e 2.
e) 6, 3 e 3.
Referências
ATKINS, P.; JONES, L. Princípios de química: questionando a vida moderna e o meio ambiente. 3ª ed. Porto Alegre: Bookman Companhia, 2001. p. 602-606.
LISBOA, J. C. F. Química: ensino médio 2º ano. São Paulo: Edições SM, 2012. v. 2. p.114-203
REAÇÕES de oxidação-redução. Khan Academy, [s.l.], [20--]. Disponível em: https://pt.khanacademy.org/science/chemistry/chemical-reactions-stoichiome/types-of-chemical-reactions/a/oxidation-number#:~:text=Uma%20rea%C3%A7%C3%A3o% 20de%20oxida%C3%A7%C3%A3o%2Dredu%C3%A7%C3 %A3o% 2C%20ou%20rea%C3%A7%C3%A3o%20redox%2C% 20%C3%A9,as%20mol%C3%A9culas%20envolvidas%20na%20rea%C3%A7%C3%A3o. Acesso em: 28 mai. 2021.
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021