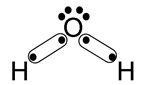
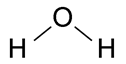
Ligações Químicas
IFSP - Cursinho Popular
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Ligações Químicas. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/quimica.html. Acesso em: [data de acesso].
Introdução
Tópicos: Contextualização; Estabilidade e Regra do Octeto; Ligação iônica; A formação do composto iônico; Formulação dos compostos iônicos; Ligações Covalentes; A formação do composto molecular; Formulação dos compostos moleculares; Exceção à regra do octeto; Expansão do octeto; Ligações Metálicas; Ligas Metálicas; Questões.
Contextualização
De maneira geral, dois ou mais átomos se aproximam estabelecendo ligações entre si no sentido de diminuir a energia do sistema. As ligações químicas podem ser classificadas de acordo com os átomos que participam da ligação e da diferença de eletronegatividade entre estes átomos.Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Estabilidade e Regra do Octeto
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Ligações Químicas. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/quimica.html. Acesso em: [data de acesso].
A grande maioria dos elementos químicos são encontrados na natureza ligados uns aos outros formando as inúmeras substâncias simples e compostas que conhecemos. A formação de substâncias simples e compostas é um processo exotérmico, ou seja, ocorre com liberação de energia para o meio. Dessa forma, os átomos são mais estáveis quando estão ligados uns aos outros do que isolados (sem ligação).
“ Na natureza tudo tende ao seu estado de menor energia. ”
Os únicos elementos que conseguimos encontrar de forma isolada, ou seja, sem estar ligada a nenhum outro átomo, são os gases nobres: hélio, neônio, argônio, criptônio, xenônio e radônio. Sabemos que a propriedade química dos elementos tem relação direta com as suas respectivas configurações eletrônicas. Sabendo disso, os cientistas concluíram que os gases nobres possuíam estabilidade em função de terem a sua camada de valência (última camada) completamente preenchida com elétrons.
Vamos analisar as configurações eletrônicas dos gases nobres para ver se chegamos a uma conclusão:
2He: 1s2
10Ne: 1s2/ 2s2 2p6
18Ar: 1s2/ 2s2 2p6/ 3s2 3p6
36Kr: 1s2/2s2 2p6/ 3s2 3p6 3d10/ 4s2 4p6
54Xe: 1s2/2s2 2p6/ 3s2 3p6 3d10/ 4s2 4p6 4d10/ 5s2 5p6
86Rn: 1s2/2s2 2p6/ 3s2 3p6 3d10/ 4s2 4p6 4d10 4f14/ 5s2 5p6 5d10/ 6s2 6p6
Observe que fazendo a distribuição eletrônica dos gases nobres e organizando- os por níveis, é possível observar que para os elementos do 2º, 3º, 4 º, 5 º e 6 º nível, em sua camada de valência eles apresentam 8 elétrons. A única exceção é o hélio, que apresenta 2 elétrons.
Portanto, podemos enunciar a regra do octeto da seguinte forma:
“Os átomos de diferentes elementos em uma ligação química tendem a adquirir uma configuração eletrônica igual a de um gás nobre: 8 elétrons no nível de energia mais externo (camada de valência) ou, caso o nível de energia mais externo seja o 1º, deve apresentar 2 elétrons.” |
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
A formação do composto iônico
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Ligações Químicas. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/quimica.html. Acesso em: [data de acesso].
Ligação Iônica
Íon: é uma espécie química eletricamente carregada, podendo ser um átomo ou molécula que perdeu ou ganhou elétrons. Os íons positivos, aqueles que perderam elétrons, são chamados de cátions, enquanto os que ganharam, íons negativos, são chamados de ânions. |
A ligação Iônica se dá entre átomos de elementos metálicos e não metálicos, caracterizando uma grande diferença de eletronegatividade. Nesse tipo de ligação ocorre a transferência de elétrons da camada de valência do átomo metálico para o átomo não metálico. Desta maneira os metais, que doam elétrons, transformam-se em cátions (íons metálicos carregados positivamente) e os não metais, que recebem elétrons, transformam-se em ânions (íons não metálicos carregados negativamente).
Figura 1- Representação da transferência do elétron da camada de valência do Na para a do Cl
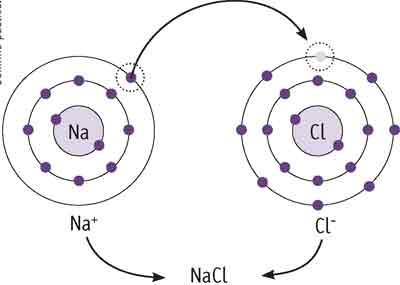
Fonte: Redu Conteúdos Escolares 1
Essa diferença de cargas gerada pela transferência de elétrons causa a atração entre os íons formados, dando origem a um composto iônico. A estrutura deste composto apresenta ordenação regular, formando agregados chamados de cristal iônico ou retículo cristalino.
Figura 2. Cristal iônico
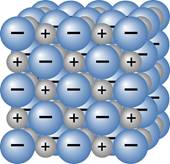
Esse tipo de ligação caracteriza as seguintes propriedades dos compostos iônicos:
- São sólidos em condições normais de temperatura pressão;
- Possuem elevados pontos de fusão e ebulição;
- Conduzem corrente elétrica quando em solução aquosa ou no estado líquido, devido ao retículo cristalino ser quebrado, fazendo com que os íons fiquem livres, possibilitando passagem de corrente elétrica.
Como descrito anteriormente a ligação iônica se baseia na transferência de elétrons entre os átomos que participam da ligação. Observe como isso ocorre, analisando a distribuição eletrônica dos ligantes, nos seguintes exemplos:
Formação do composto iônico cloreto de sódio - NaCl
|
K |
L |
M |
11Na |
2 |
8 |
1 |
17Cl |
2 |
8 |
7 |
Ao se aproximarem dos átomo de cloro, os átomos de sódio “doam” 1 elétron da sua camada de valência, se estabilizando como cátion Na+ e passando a ter 8 elétrons em sua última camada.
Já os átomos de cloro, que possuem alta afinidade eletrônica, “recebem” 1 elétron, completando sua camada de valência, se estabilizando como ânion Cl- e passando a ter 8 elétrons em sua última camada.
Como as cargas das duas espécies anulam-se (+1 do cátion e -1 do ânion) tem-se a formação do composto iônico NaCl.
Formação do composto iônico cloreto de cálcio - CaCl2
|
K |
L |
M |
N |
20Ca |
2 |
8 |
8 |
2 |
17Cl |
2 |
8 |
7 |
|
Ao se aproximarem dos átomos de cloro, os átomos de cálcio “doam” 2 elétrons da sua camada de valência, se estabilizando como cátion Ca²+ e passando a ter 8 elétrons em sua última camada.
Já os átomos de cloro, que possuem alta afinidade eletrônica, “recebem” 1 elétron, completando sua camada de valência, e se estabilizando como ânion Cl- e passando a ter 8 elétrons em sua última camada.
Para estabilizar um cátion Ca²+, formando um composto estável e eletricamente neutro, são necessárias duas (2) cargas negativas. Um ânion de cloro (Cl-) possui apenas uma carga negativa, sendo necessário duas destas espécies para a formação do composto iônico → CaCl2.
Figura 3. Transferência de elétrons entre Cálcio (Ca) e Cloro (Cl)
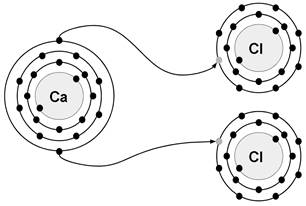
Fonte: Imagem do autor
Formulação dos compostos iônicos
Na fórmula de um composto iônico é representado primeiro pelo cátion e depois o ânion. Vale lembrar que o total de cargas positivas e negativas devem ser os mesmos.
Exemplos:
Magnésio e Flúor - Fluoreto de Magnésio
121Mg → forma o íon Mg²+
9F → forma o íon F¹-
fórmula: MgF2
Alumínio e Oxigênio - Óxido de alumínio
13Al → forma o íon Al³+
8O → forma o íon O²-
fórmula: Al2O3
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
A formação do composto molecular
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Ligações Químicas. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/quimica.html. Acesso em: [data de acesso].
Ligação Covalente
A ligação covalente ocorre entre os átomos de elementos não metálicos, caracterizando uma pequena diferença de eletronegatividade entre os ligantes, podendo até não existir essa diferença (quando os ligantes são o mesmo átomo). Neste tipo de ligação, os átomos não metálicos se unem pelo compartilhamento de um, dois ou até três pares de elétrons.
Figura 4. Representação da ligação covalente e a sobreposição das orbitais dos átomos ligantes
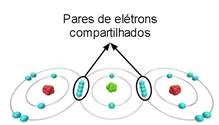
Fonte: Mundo Educação 3
Os compostos moleculares, como são chamados os compostos que apresentam ligações covalentes, podem ser polares ou apolares. Quando existe uma diferença de eletronegatividade entre os átomos ligantes, os elétrons tendem a de deslocar para o átomo mais eletronegativo, gerando uma carga parcial negativa devido a maior densidade de elétrons presentes em uma única região dando origem à um polo negativo. Na região onde se encontra o átomo menos eletronegativo passa a existir um polo positivo em função da baixa densidade de elétrons naquele espaço.
Figura 5. Composto molecular
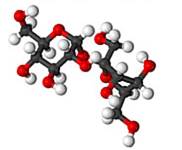
Fonte: PrePara Enem (Adaptado) 4
Esse tipo de ligação caracteriza as seguintes propriedades dos compostos moleculares:
- Podem ser sólidos, líquidos ou gasosos nas condições normais de temperatura e pressão;
- Não conduzem corrente elétrica nos estados sólido e líquido;
Como descrito anteriormente a ligação covalente se baseia no compartilhamento de pares de elétrons entre os átomos que participam da ligação. Observe como isso ocorre, analisando a distribuição eletrônica dos ligantes, nos seguintes exemplos:
Formação do composto molecular Cl2 - (di)cloro
|
K |
L |
M |
17Cl |
2 |
8 |
7 |
17Cl |
2 |
8 |
7 |
Observe que os dois átomos de cloro (Cl) precisam de mais um elétron cada para completar sua camada de valência e tornarem-se mais estáveis. Note que nesta situação, diferentemente da ligação iônica, os dois ligantes não possuem afinidade para perder elétrons, apenas para receber e é por isso que ao invés de uma troca, ocorre um compartilhamento de elétrons. Ao formar a ligação dois elétrons são compartilhados pelo par de átomos de cloro, formando a molécula Cl2.
Formação do composto molecular H2O - água
|
K |
L |
1H |
1 |
|
8O |
2 |
6 |
Novamente, nesta situação, os dois ligantes têm afinidade para receber elétrons. No entanto, o hidrogênio necessita de apenas um elétron para completar sua camada de valência, enquanto que o oxigênio necessita de dois. Já que um átomo de hidrogênio pode compartilhar apenas um elétron, serão necessários dois átomos de hidrogênio para ligar com um único átomo de oxigênio, formando o composto molecular H2O.
Formulação dos compostos moleculares
Existem três formas principais de representação das moléculas:
- Estrutura ou Fórmula de Lewis: Indica os elétrons da camada de valência dos átomos e os pares de elétrons compartilhados por eles.
|
- Fórmula Molecular: Considerada a mais simples, indica apenas os átomos da ligação e sua proporção na molécula.
|
- Fórmula Estrutural: Indica a ligação entre os átomos das moléculas, sendo cada par representado por um traço (-).
|
Exceção a Regra do Octeto É importante ressaltar que a regra do octeto possui suas exceções, sendo possível que determinados átomos estejam em sua forma estável sem possuir uma distribuição eletrônica igual a de um gás nobre. Expansão do Octeto
Contração do Octeto Note que o Berílio pode fazer somente 2 ligações, se estabilizando com apenas 4 elétrons em sua camada de Valência. |
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Ligação Metálica
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Ligações Químicas. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/quimica.html. Acesso em: [data de acesso].
Como o próprio nome indica, a ligação metálica ocorre entre átomos de elementos metálicos, caracterizando uma baixíssima diferença de eletronegatividade. Neste tipo de ligação os elétrons da camada de valência dos metais movimentam-se livremente entre as eletrosferas dos átomos ligantes, formando uma “nuvem eletrônica”.
Figura 6. Modelo do Mar de Elétrons
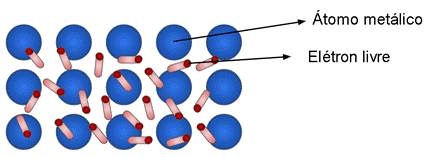
Fonte: Pontes (2013, adaptado) 6
Esse tipo de ligação caracteriza as seguintes propriedades dos metais e ligas metálicas:
- Conduzem corrente elétrica devido à livre movimentação de elétrons nas eletrosferas dos ligantes;
- São sólidos em condições normais de temperatura e pressão, com exceção do mercúrio (Hg), que é líquido;
- Possuem elevados pontos de fusão e ebulição;
- Apresentam boa condutividade térmica;
Ligas Metálicas
Uma das propriedades especiais dos metais é que esses elementos podem formar as chamadas ligas metálicas, que são a mistura de dois ou mais metais. As Ligas metálicas são mais utilizadas na indústria do que os metais puros pois conciliam características dos metais que a compõem, além de que, de maneira geral, estas ligas apresentam maior resistência mecânica. Os átomos dos elementos que compõem a liga se unem por ligação metálica e não são representados por fórmulas químicas, além de poderem apresentar diferentes composições.
Exemplos de ligas metálicas
- Aço → Ferro (Fe) e Carbono (C);
- Bronze → Cobre (Cu) e Estanho (Sn);
- Latão → Cobre(Cu) e Zinco (Zn).
É isso aí! Finalizamos o capítulo sobre Ligações Químicas. E aí, pronto para resolvermos alguns exercícios? |
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Exceção a Regra do Octeto
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Ligações Químicas. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/quimica.html. Acesso em: [data de acesso].
Exceção a Regra do Octeto
É importante ressaltar que a regra do octeto possui suas exceções, sendo possível que determinados átomos estejam em sua forma estável sem possuir uma distribuição eletrônica igual a de um gás nobre.
Expansão do Octeto
O fenômeno da expansão do octeto ocorre somente com átomos não metálicos que possuem três ou mais camadas eletrônicas (elementos não metais do 3° período ou além), e consiste em átomos que se encontram em um estado estável mas com mais de 8 elétrons em sua última camada. Mais comumente observado nas ligações do enxofre (S) e do fósforo (P), esse fenômeno ocorre pois estes elementos possuem uma subcamada "d" que comporta até 14 elétrons. Vamos analisar o caso do enxofre (S):
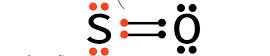
Note que o Enxofre já estaria estável seguindo a regra do octeto, mas, no entanto, o Enxofre ainda possui elétrons livres e sua subcamada ainda não está completa, o que pode ocasionar na formação dos compostos:
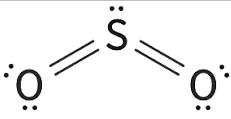
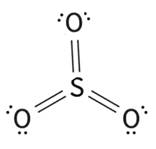
No dióxido de enxofre (SO2) e o trióxido de enxofre (SO3), o átomo de S possui 10 e 12 elétrons respectivamente, caracterizando uma expansão do octeto
Contração do Octeto
O fenômeno da contração do octeto ocorre geralmente com átomos do segundo período e consiste em átomos que se encontram em um estado estável, mas com menos de 8 elétrons em sua última camada. Mais comumente observado nas ligações do Berílio (Be) e do Boro (B), esse fenômeno ocorre, pois, estes elementos possuem muita atração entre núcleo e elétron, dificultando a formação de íons. Eles então participam de ligações covalentes, mas por terem poucos elétrons na camada de valência, não conseguem compartilhar elétrons suficientes para conseguirem 8 elétrons em sua última camada. Vamos observar o caso do Berílio:

Note que o Berílio pode fazer somente 2 ligações, se estabilizando com apenas 4 elétrons em sua camada de Valência.
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Exercícios
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Ligações Químicas. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/quimica.html. Acesso em: [data de acesso].
1- (UFC-CE) Analise as propriedades físicas na tabela abaixo
|
Amostra |
Ponto de fusão (°C) |
Ponto de ebulição (°C) |
Condução de corrente elétrica a 25 °C |
Condução de corrente elétrica a 1000 °C |
|
A |
801 |
1.413 |
Isolante |
Condutor |
|
B |
43 |
182 |
Isolante |
- |
|
C |
1.535 |
2.760 |
Condutor |
Condutor |
Segundo a tabela, as substâncias A, B e C podem apresentar estados físicos diferentes devido ao tipo de ligação. Conclui-se então que o composto iônico, o molecular e o metálico são, respectivamente:
a) A, B, C.
b) B, C, A.
c) C, A, B.
d) C, B, A.
e) A, C, B.
2- (Ufal) Cada átomo de F(Z=9) possui 7 elétrons na camada de valência. Átomos de F não são estáveis nas condições ambiente de P e T. Unem-se facilmente formando a molécula F2 com ligação por 1 par de elétrons entre os átomos. Sendo assim, o número total de elétrons que circundam cada átomo de F, na molécula F2 é
a) 18
b) 14
c) 12
d) 10
e) 2
3- (Unesp) Qual a fórmula do composto formado entre os elementos 20Ca40 e 17Cl35 e qual a ligação envolvida?
a) CaCl, iônica.
b) CaCl, covalente.
c) CaCl2, iônica.
d) CaCl2, covalente.
e) CaCl, iônica.
4- (Mack-2001) Na ligação entre átomos dos elementos químicos 15P³¹ e Ca, que tem 20 prótons, forma-se o composto de fórmula:
a) CaP
b) Ca3P
c) CaP3
d) Ca2P3
e)Ca3P2
5- (UFLA-2001) O sal de cozinha (NaCl), o ácido clorídrico (HCl) e a glicose (C6H12O6) apresentam em suas estruturas, respectivamente, ligações do tipo
a) iônica, iônica e iônica.
b) covalente, covalente e covalente.
c) metálica, covalente e covalente.
d) iônica, covalente e covalente.
e) iônica, metálica e covalente.
6- (UFSCar-2001) Apresentam somente ligações covalentes:
a) NaCl e H2SO4.
b) Mn2O3 e MgH2.
c) HCl e Cl2O3.
d) KNO3 e LiF.
e) LiOH e CsI.
7- (UFRN) Na série de compostos: NaCl, CO2, H2O e CaCl2, predominam, respectivamente, os seguintes tipos de ligação química:
a) iônica, covalente polar, covalente polar e iônica
b) iônica, covalente apolar, covalente coordenada e iônica
c) iônica, covalente apolar, covalente polar e covalente coordenada
d) iônica, covalente polar, covalente coordenada e covalente polar
e) iônica, covalente coordenada, covalente polar e iônica.
8- (PUCCamp-1998) Considere os seguintes compostos do enxofre:
I. SO3 - um dos poluentes responsáveis pela formação da "chuva ácida".
II. Na2SO4 - utilizado na obtenção de papel sulfite.
III. ZnS - componentes da blenda, minério de zinco. Em relação ao tipo de ligação química que essas substâncias apresentam, é correto afirmar que:
a) são todas moleculares.
b) são todas iônicas.
c) I e II são moleculares e III é iônica.
d) I é iônica e II e III são moleculares.
e) I é molecular e II e III são iônicas.
9- (Mackenzie) Em relação à combinação de 1 mol de átomos de fluor (Z = 9) com 1 mol de átomos de hidrogênio (Z = 1), pode-se afirmar que: Eletronegatividade: F = 4,0 e H = 2,1
a) a ligação iônica é predominante.
b) formam-se moléculas apolares.
c) cada átomo de flúor liga-se a dois átomos de hidrogênio.
d) predomina a ligação covalente polar.
e) formam-se 2 mols de moléculas.
Bibliografia Consultada
O QUE são Ligações Químicas - Distribuição Eletrônica. Redu Conteúdos Escolares, [2019?]. 4
FOGAÇA, Jennifer Rocha Vargas. Ligação covalente, Mundo Educação, c2021. 4
FOGAÇA, Jennifer Rocha Vargas. Compostos covalentes e moleculares, PrePara Enem, c2021. 5
PONTES, Emanuel. Ligação metálica 6
Link das imagens
figura_1: https://redu.com.br/quimica/o-que-sao-ligacoes-quimicas-distribuicao-eletronica/
figura 2: https://mundoeducacao.uol.com.br/quimica/ligacao-covalente.htm
figura 3: eu fiz
figura 4: https://www.preparaenem.com/quimica/compostos-covalentes-moleculares.htm
figura 5: https://brainly.com.br/tarefa/13646095
figura 6: https://brainly.com.br/tarefa/13646095
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021