Óxidos ácidos e poluição atmosférica
IFSP - Cursinho Popular
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Óxidos ácidos e poluição atmosférica. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/poluicao-atmosferica.html. Acesso em: [data de acesso].
Introdução
Tópicos: Contextualização; Óxidos ácidos; Dióxido de carbono e efeito estufa; Chuva ácida; Óxidos de enxofre; Óxidos de nitrogênio; Questões.
Contextualização
Atmosfera é a camada gasosa que envolve nosso planeta. Composta por cerca de 78% de nitrogênio diatômico (N2), 21% de oxigênio diatômico (O2), 1% de Argônio (Ar) e 0,04% de dióxido de carbono (CO2) a atmosfera desempenha papel fundamental na vida terrestre.
Ela é responsável pela absorção de parte da radiação solar, permitindo que apenas as ondas Ultra Violeta (UV) de comprimento maior que 300 nm (comprimentos menores que estes destroem os tecidos vivos), a luz visível e o Infravermelho (IV) nos atinjam. É também responsável pelo aquecimento e redução de variações extremas na temperatura da superfície terrestre, uma vez que retém o calor emitido pelo sol (radiação). Além disso, a atmosfera possui papel importantíssimo no ciclo hidrológico terrestre, pois permite o ciclo de evaporação e condensação da água.
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Óxidos ácidos
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Óxidos ácidos e poluição atmosférica. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/poluicao-atmosferica.html. Acesso em: [data de acesso].
Os óxidos são compostos binários nos quais um de seus componentes é o oxigênio e o outro é um elemento qualquer menos eletronegativo. Quando este segundo elemento é um não metal, isto é, quando o óxido é não metálico, o composto reage com bases formando sal e água, sendo classificado então como óxido ácido.
Os óxidos ácidos, embora possuam ampla aplicação na indústria, também são um dos grandes responsáveis pela poluição atmosférica. Dentre este grupo de compostos destacam-se os óxidos de carbono, de nitrogênio e de enxofre.
Dióxido de carbono e o efeito estufa
Efeito estufa é um fenômeno natural causado pela retenção do calor emitido pelo Sol na atmosfera terrestre. O Sol emite radiação em diferentes comprimentos de onda mas, no entanto, apenas alguns desses comprimentos conseguem penetrar a atmosfera do planeta. Parte dessa radiação que penetra na atmosfera é refletida pela superfície do planeta e é absorvida pelos chamados “gases do efeito estufa”, sendo o principal deles o dióxido de carbono (CO2). O efeito estufa é, portanto, um processo que mantém aquecida a superfície terrestre, criando um ambiente habitável para diversos seres vivos, inclusive os humanos.
Figura 1 - Representação do esquemática do Efeito Estufa
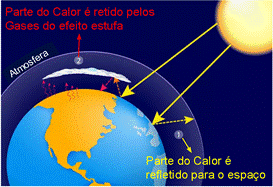
Fonte: Educa Mais Brasil (Adaptado) 1
Este fenômeno, no entanto, tornou-se preocupante quando a concentração dos gases do efeito estufa na atmosfera atingiu patamares nos quais catástrofes ambientais começaram a ocorrer devido ao aumento da temperatura média da atmosfera e dos oceanos.
Figura 2. Gráfico da emissão, em bilhões de toneladas, de gás carbônico. O gráfico ilustra também a variação da temperatura média do mundo.
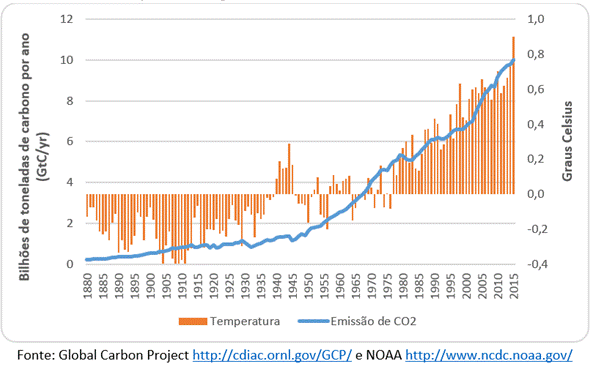
O Aquecimento Global, nome dado a esse aumento de temperatura causado pelo efeito estufa é, sem sombra de dúvidas, um dos principais desafios enfrentados pela sociedade contemporânea. No último século foi constatado o aumento médio de 0,76 °C e o nível do mar subiu em média 17cm. Os números em si podem não parecer tão assombrosos, mas as consequências dessas pequenas mudanças podem ser chocantes. Somente com este pequeno aumento, especialistas identificaram mudanças no comportamento de seres vivos, além de que a subida do nível do mar já ameaça a vida de pessoas que moram em pequenas ilhas.
Infelizmente, a perspectiva é de que o aquecimento global continue se agravando ao longo do tempo. No entanto, hoje muito se discute sobre práticas sustentáveis e que favoreçam o meio ambiente. Hoje, a humanidade enfrenta o desafio de viver em harmonia com a natureza.
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Chuva ácida
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Óxidos ácidos e poluição atmosférica. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/poluicao-atmosferica.html. Acesso em: [data de acesso].
A chuva ácida é um fenômeno decorrente da diminuição do da água devido ao equilíbrio químico que ela atinge com os óxidos presentes na atmosfera. O dióxido de carbono (CO2) atmosférico reage com a água da chuva produzindo ácido carbônico (H2CO3), como demonstra a equação a seguir:
![]()
A água pura possui pH 7,0 mas, quando em equilíbrio com o gás carbônico atmosférico, esse pH cai para 5,6. Mesmo que isso faça com que a chuva fique um pouco ácida, só é considerado que a chuva possui excesso de acidez quando seu pH fica menor do que 5,6, isso porque a presença de ácido carbônico na chuva não é tida como poluição, mas sim como uma acidez natural, pois não causa problemas ambientais.
A chuva ácida pode causar a acidificação da água de lagos. Em pequenas proporções essa acidificação pode matar alguns insetos e algas, afetando desta forma a cadeia alimentar desses ecossistemas. Já em grandes proporções a acidificação dos lagos pode causar a intoxicação da maioria dos seres vivos que lá habitam.
Outro problema associado à chuva ácida é a acidificação dos solos. Quando isso acontece, as grandes concentrações de íons de hidrogênio (H+) no solo comprometem a disponibilidade de nutrientes para as plantas, prejudicando desta forma a produtividade das culturas cultivadas. A acidificação dos solos é um dos principais problemas relacionados à agricultura e é combatida pela prática da Calagem, um processo que constitui na neutralização da acidez pela adição de, geralmente, calcário e cal (CaCO3 e CaO). Em alguns solos a presença dessas substâncias já é natural, sendo capazes de neutralizar, pelo menos parcialmente, a acidez do solo.
Figura 4 - Esquema da chuva ácida
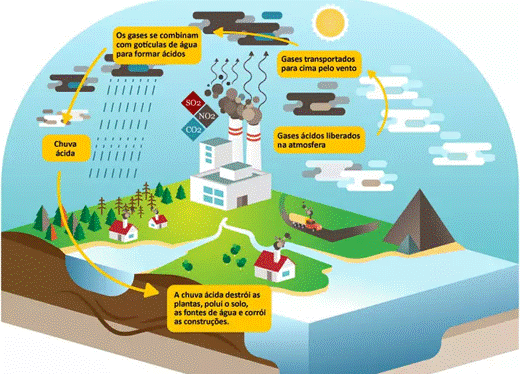
Fonte: Educa Mais Brasil 2
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Chuva ácida
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Óxidos ácidos e poluição atmosférica. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/poluicao-atmosferica.html. Acesso em: [data de acesso].
A chuva ácida também causa a corrosão da superfície de monumentos históricos e edifícios feitos de mármore (CaCO3), por causa da reação com o ácido:
![]()
Reação entre o mármore e um ácido. O ácido está representado de forma genérica por H+
Figura 4. Monumento de mármore desgastado pela chuva ácida.

Fonte: Geografalando
Disponível em: 3
Os óxidos de enxofre e de nitrogênio são os principais causadores e intensificadores da chuva ácida, a seguir veremos um pouco mais sobre estas substâncias e como elas estão relacionadas com este fenômeno
Óxidos de Enxofre
Os óxidos de enxofre são as principais substâncias responsáveis pelo agravamento do fenômeno da chuva ácida. O dióxido de enxofre (SO2) é formado na queima de combustíveis fósseis, dentre eles destacam-se a gasolina, devido à quantidade expressiva de sua utilização, o carvão e o óleo diesel, resultado de sua alta impureza, possuindo vastas quantidades de enxofre (S) em sua composição.
O dióxido de enxofre (SO2) pode reagir com a água formando o ácido sulfuroso (H2SO3).
![]()
O dióxido de enxofre (SO2), na presença de oxigênio atmosférico, também pode sofrer oxidação formando o trióxido de enxofre (SO3). Este novo óxido também pode reagir com a água da chuva, formando o ácido sulfúrico (H2SO4), um ácido forte.
![]()
![]()
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Chuva ácida
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Óxidos ácidos e poluição atmosférica. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/poluicao-atmosferica.html. Acesso em: [data de acesso].
Óxidos de Nitrogênio
A formação do monóxido de nitrogênio (NO) a partir do nitrogênio gasoso (N2) e o oxigênio molecular (O2) necessita de altos níveis de energia para poder ocorrer. Durante a queima de combustível em motores e em fornos industriais, as altas temperaturas desses processos fornecem a energia necessária para que esta reação ocorra.
![]()
Na atmosfera, na presença de O2, o monóxido de nitrogênio pode ser oxidado, resultando na formação de dióxido de nitrogênio, que possui coloração marrom.
![]()
É comum que, em cidades onde há grande circulação de veículos, a formação de dióxido de nitrogênio na atmosfera somada a emissão de material particulado faça com que o céu tenha tonalidade mais escura.
Figura 5. O dióxido de nitrogênio, juntamente com outras partículas como a fuligem, fazem com que o céu tenha uma tonalidade marrom.

Fonte: Via Trolebus 4
O dióxido de nitrogênio por sua vez, pode reagir com a água de chuva, formando o ácido nítrico (HNO3), contribuindo para o agravamento da chuva ácida.
![]()
Figura 6 - Esquema das reações químicas envolvidas na acidificação da chuva
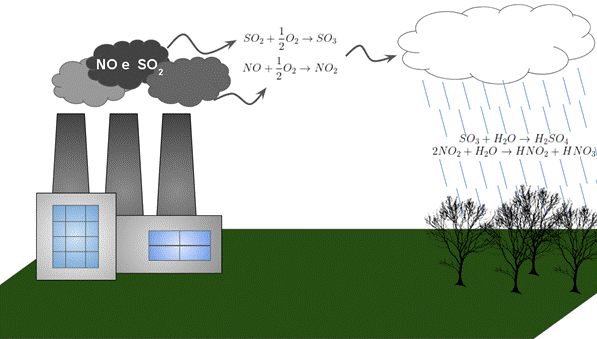
Fonte: Laifi (Adaptado) 5
Como podemos prevenir, evitar ou minimizar estes fenômenos prejudiciais ao meio ambiente?
Ao mesmo passo que é importante discutir e entender a relação entre os óxidos ácidos e a poluição atmosférica, também não podemos deixar de estudar quais práticas são utilizadas para prevenir, evitar e minimizar estes fenômenos.
- A queima de combustíveis fósseis em usinas termoelétricas e nos motores a combustão dos veículos produzem grandes quantidades dos gases que contribuem tanto para o aquecimento global quanto para a formação e intensificação da chuva ácida. A busca e o desenvolvimento de tecnologias e combustíveis que permitam a produção de energia de forma mais limpa e renovável é de fundamental importância.
- Atualmente, os carros que possuem motores de combustão são equipados com uma peça chamada "catalisador", que está conectada ao escapamento (sistema de exaustão). Essa peça é responsável por transformar os gases poluentes produzidos pela combustão no motor (CO, NOx, CxHy, etc.) em compostos mais seguros (CO2, H2O, N2, etc.).
- É importante também que nós, cidadãos, tenhamos consciência de nossos atos e como eles afetam o globo. É imprescindível que, no nosso dia a dia, busquemos praticar hábitos mais sustentáveis. Coisas como a redução de consumo, uso de transporte coletivo ao invés do individual, reutilização de bens que seriam descartados, reciclagem e muitos outros métodos.
- O descarte adequado do lixo e resíduos é extremamente importante. Como vimos, as algas marinhas e o fitoplâncton que habitam os oceanos são os principais responsáveis pelo “Sequestro de carbono" da atmosfera, mas atualmente, a existência de ilhas de lixo em alto mar faz afeta o ecossistema destes seres, atrapalhando seu processo de fotossíntese.
- Embora não seja uma prática em si, vale citar a existência de agências que regulam a emissões de poluição das indústrias. Elas possuem papel fundamental pois além de demonstrarem resultado efetivo na redução da emissão de poluentes pelas empresas, também incentivam a prática de alternativas mais sustentáveis e, consequentemente, o desenvolvimento de tecnologias sustentáveis.
Aqui estão alguns links para aprofundamento:
Companhia Ambiental do Estado de São Paulo - Qualidade do ar https://cetesb.sp.gov.br/ar/
World Air quality Index - https://waqi.info/pt/
É isso aí! Finalizamos o capítulo sobre Óxidos ácidos e poluição atmosférica. E aí, pronto para resolvermos alguns exercícios? |
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
.
Exercícios
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Óxidos ácidos e poluição atmosférica. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/poluicao-atmosferica.html. Acesso em: [data de acesso].
1- (UFRJ) A espécie química H2S é um gás venenoso incolor, formado na putrefação de substâncias orgânicas naturais que contenham enxofre, sendo responsável pelo cheiro de ovo podre. Queima no ar com chama azul produzindo SO2 e H2O. É encontrado em pequenas quantidades em águas minerais (sulfurosas), sua utilização é restrita a processos de análise química.
a) A substância H2S quando se encontra em solução aquosa forma um ácido forte
b) O composto SO2 é um óxido básico.
c) O composto SO2 reage com água produzindo H2SO3 por ser óxido ácido.
d) O composto SO2 não reage com água
e) O H2S é um ácido de arrhenius classificado como hidrácido e oxiácido
2- (UFPE) Anidrido sulfúrico é a denominação do óxido de enxofre, que, ao reagir com água, forma o ácido sulfúrico, sendo assim um dos causadores das chuvas ácidas. Qual deve ser a fórmula molecular desse óxido?
a) SO2.
b) S2O3.
c) SO3.
d) SO4.
e) S2O4.
3- (Fuvest-SP) Com base na frase seguinte: “A água da chuva em ambientes não poluídos, na ausência de raios e relâmpagos, é ácida devido à dissolução do..., que dá origem ao ácido...”, identifique a alternativa correta.
a) CO2, carbônico.
b) SO2, sulfuroso.
c) P2O5, fosfórico.
d) N2O3, nitroso.
e) N2O5, nítrico.
4- (UFSM-RS) O fenômeno da chuva ácida, que lentamente destrói ecossistemas e monumentos e causa sérios danos à saúde do ser humano, é provocado pela presença dos ácidos sulfúrico e nítrico na água da chuva, formados a partir das reações:
SO3 + H2O→ H2SO4
2 NO2 + H2O→ HNO3 + HNO2
Analise as afirmativas.
I. Na equação de formação do ácido sulfúrico, o SO3 atua como um óxido básico.
II. Os óxidos de enxofre e de nitrogênio atuam como óxidos ácidos.
III. Nas equações apresentadas, o ácido sulfúrico é formado a partir do trióxido de enxofre e os ácidos nítrico e nitroso, a partir do monóxido de nitrogênio.
Está(ão) correta(s):
a) apenas I.
b) apenas II.
c) apenas III.
d) apenas I e II.
e) apenas I e III.
5- (Puc-Campinas-SP) Quando o solo é excessivamente ácido, agricultores procuram diminuir a acidez por meio da adição de substâncias com propriedades alcalinas. Com essa finalidade, um dos produtos utilizados é o:
a) NaCl.
b) CaO.
c) Na2SO4.
d) NH4NO3.
e) KClO4.
6- (FEI-SP) Na noite de 21 agosto de 1986, uma nuvem tóxica de gases saiu do fundo de um lago vulcânico, o lago de Nios, na África. Técnicos concluíram que a nuvem de gases continha sulfeto de hidrogênio, monóxido de carbono, dióxido de carbono e dióxido de enxofre. O item que contém corretamente as fórmulas dos gases citados acima é:
a) H2SO4, CO, CO2 e SO3.
b) CaO, H2SO3, CO2 e H2SO4.
c) CO, CO2, SO3 e H2SO4.
d) CO, H2S, SO2 e CO2.
e) H2S, CO, CO2 e SO2.
7- (Fei-SP) Nos últimos anos, a cidade de São Paulo vem sofrendo os efeitos da chuva ácida. O caráter ácido da chuva é causado pela presença de:
a) monóxido de carbono.
b) amônia.
c) óxidos de enxofre.
d) sais de fósforo.
e) partículas de carvão.
8- (FMTM-MG adaptada) Considere as seguintes informações sobre três substâncias no estado gasoso.
I) Sofre interação na atmosfera, transformando-se em SO3 e, subsequentemente, em H2SO4, que é um dos principais responsáveis pela chamada chuva ácida.
II) A sua presença na atmosfera é natural. Quando chove, ocorre uma reação entre ele e a água da chuva, produzindo um ácido que deixa a chuva ligeiramente ácida, já que se trata de um ácido fraco.
III) É emitido na combustão em motores ou em fornalhas devido a alta temperatura e pressão, quando na atmosfera faz com que o céu adquira tonalidade marrom.
As informações I, II e III referem-se, respectivamente, a:
a) SO2, CO, NO2
b) SO2, CO2, NO2
c) SO2, O2, CO
d) SO2, CO2, NO
e) SO2, NO2, CO2
Bibliografia Consultada
ALVES, Jessica. Efeito estufa, Educa Mais Brasil 6
ALVES, José Eustáquio Diniz. Aquecimento global e Orçamento Carbono. EcoDebate 7
CAIUSCA, Alana. Chuva ácida, Educa Mais Brasil, 02 jan. 2019. 8
COMPANHIA AMBIENTAL DO ESTADO DE SÃO PAULO. Qualidade do ar. São Paulo: CETESB, c2021. 9
FONTANAILLES, Gilvan. Clima: impactos ambientais - chuva ácida, Geografalando, 24 dez. 2012. Disponível em: 10
LOBO, Renato. Emissão de gases do efeito estufa aumenta em São Paulo. Via Trollebus, 15 nov. 2012. 11
SOUSA, Rafaela. Efeito estufa, Brasil Escola, [2020?]. 12
Links das imagens
Figura 1: https://www.ecodebate.com.br/2016/11/11/aquecimento-global-e-orcamento-carbono-artigo-de-jose-eustaquio-diniz-alves/
Figura 2: https://geografalando.blogspot.com/2012/12/climas-impactos-ambientais-chuva-acida.html
Figura 3: https://viatrolebus.com.br/2012/11/emissao-de-gases-de-efeito-estufa-aumenta-em-sao-paulo/
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021