
Polaridade
IFSP - Cursinho Popular
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Polaridade. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/polaridade.html. Acesso em: [data de acesso].
Tópicos: Contextualização (polaridade); geometria molecular; momento dipolar e polaridade; solubilidade; tensoativos; Introdução (forças intermoleculares); intensidade das forças intermoleculares; ponto de ebulição; questões
Contextualização
O conceito de polaridade é relacionado à capacidade dos átomos que formam uma ligação covalente possuírem de atrair cargas elétricas; essa região em que há a formação dessas cargas nós chamamos de polos. Esta capacidade, por sua vez, tem relação com o conceito de eletronegatividade, que é a capacidade de um elemento químico atrair um par de elétrons para perto de si, em uma ligação química.
Esse assunto é muito importante, pois é a base para entendermos o comportamento das substâncias com base nas características da ligação e porque algumas substâncias são imiscíveis, como água e óleo, por exemplo.Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Geometria Molecular
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Polaridade. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/polaridade.html. Acesso em: [data de acesso].
O inglês Ronald James Gillespie desenvolveu um modelo capaz de prever a geometria molecular das moléculas que realizam ligações covalentes (compartilham elétrons) a partir de sua fórmula eletrônica.
Segundo esse modelo, os pares de elétrons compartilhados localizados na camada de valência devem se distanciar o máximo possível um dos outros, devido à forte repulsão sentida entre eles, independentemente se esses pares fazem parte da ligação covalente ou se estão livres. Para efeitos de geometria, graças ao caráter direcional da ligação covalente, no caso de ligação dupla ou tripla, os pares de elétrons envolvidos comportam-se como se fossem um único par.
A geometria das ligações químicas é importante, pois irão nos ajudar a definir se a ligação química será polar ou apolar.
- Molécula com 2 átomos
Neste caso a geometria molecular será sempre linear. Dessa forma, não haverá átomo central, conforme podemos ver na figura 1.
Figura 1 - Molécula com três átomos. Geometria linear
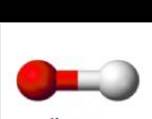
Fonte: Shuterstock (Adaptado) 1
Exemplo: O2
![]()
O ângulo de ligação previsto é de 180°.
- Molécula com 3 átomos
Nesse caso, haverá um átomo central e ele determinará a geometria da ligação.
Se o átomo central não possuir par de elétrons emparelhados livres, a geometria da molécula será linear, com ângulo de ligação previsto de 180°, conforme podemos ver na figura 2.
Figura 2 - Molécula com três átomos. Geometria linear.

Fonte: Shuterstock (Adaptado) 2
Exemplo: CO2
![]()
Caso contrário, a geometria será angular, com ângulo de ligação variável, conforme podemos ver na figura 3. Isso acontece, porque os pares de elétrons não-ligantes geram uma repulsão sobre os demais, por isso haverá a formação do ângulo.
Figura 3 - Molécula com três átomos. Geometria angular.
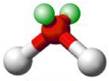
Fonte: Shuterstock (Adaptado) 2a
Exemplo: H2O
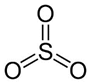
- Molécula com 4 átomos
Se a molécula possuir um átomo central das quais todas as ligações partem, e ele não possuir par de elétrons emparelhados livres, a geometria da molécula será trigonal planar, com ângulo de ligação previsto de 120°, conforme podemos ver na figura 4.
Figura 4 - Molécula com quatro átomos. Geometria trigonal planar
 3 4 5
3 4 5
Exemplo: SO3
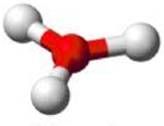
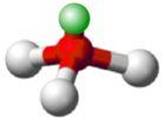
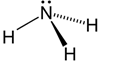
Caso contrário, a molécula será piramidal (pirâmide trigonal), com ângulo de ligação variável, conforme podemos ver na figura 5.
Figura 5 - Molécula com quatro átomos. Geometria piramidal.
Fonte: Shuterstock (Adaptado) 6
Exemplo: NH3
- Molécula com 5 átomos
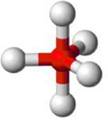
Se a molécula possuir 5 átomos, com um átomo no centro de onde partem as ligações com os demais, a geometria será tetraédrica, com ângulo de ligação previsto de 109°28’, conforme na figura 6.
Observação (clicar) Existem exceções, como é o caso do XeF4 que apresenta uma geometria quadrada planar, por exemplo. (inserir imagem abaixo tbm)
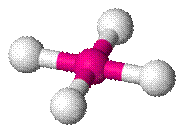
Figura 6 - Molécula com cinco átomos. Geometria tetraédrica.
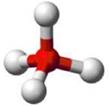
Fonte: Shuterstock (Adaptado) 2a
Exemplo: CH4
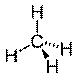
- Molécula com 6 átomos
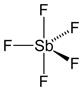
As moléculas que apresentam 6 átomos, com a presença de um átomo central, do qual partem as ligações com os demais possuem geometria bipirâmide trigonal, com ângulo de ligação previsto é de 90° e 120°, conforme podemos ver na figura 7.
Observação: (clicar) Também existem exceções, como é o caso do BrF5, por exemplo, que possui uma geometria piramidal quadrada.(inserir imagem rosa abaixo tbm)
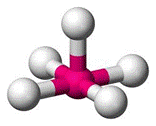
Figura 7 - Molécula com seis átomos. Geometria bipirâmide trigonal
Fonte: Shuterstock (Adaptado) 7
Exemplo: SbF5
- Molécula com 7 átomos
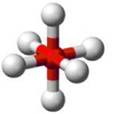
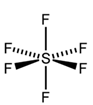
Nesse caso, a geometria será octaédrica, com ângulo de ligação previsto de 90°, conforme podemos ver na figura 8.
Figura 8 - Molécula com sete átomos. Geometria octaédrica.
Fonte: Shuterstock (Adaptado) 8
Exemplo: SF6
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Momento Dipolar e Polaridade
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Polaridade. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/polaridade.html. Acesso em: [data de acesso].
Quando temos uma ligação química entre dois elementos diferentes, o elemento mais eletronegativo tenderá a atrair para perto de si o par de elétrons compartilhados, criando um deslocamento dos elétrons, e adquirindo uma carga parcial negativa (δ-). O outro elemento, menos eletronegativo, irá adquirir uma carga parcial positiva (δ+), pois o par de elétrons da ligação se afastou dele.
Quando dois átomos de uma ligação química são iguais, ou seja, são do mesmo elemento químico, não há diferença de eletronegatividade entre eles. Neste caso, o par de elétrons da ligação covalente estará igualmente distribuído entre os dois átomos.
O produto do módulo da carga elétrica parcial (δ), pela distância, d, entre o núcleo dos átomos ligados nos fornece o momento dipolar (![]() ).
).
![]()
A convenção que se utiliza é a de que o vetor sempre aponta no sentido do deslocamento da nuvem eletrônica.
A geometria da molécula também será importante para descobrirmos a polaridade da molécula, portanto você deve colocar em prática os conhecimentos que você adquiriu anteriormente quando for desenhar a estrutura da molécula.
Se a soma vetorial de todos os momentos dipolares for igual a zero, esta será uma molécula apolar; caso a soma vetorial seja diferente de zero, ela será uma molécula polar.
Com os exemplos, essa ideia ficará mais clara:
- Na figura 9 temos uma molécula de HCl. A molécula apresenta 2 átomos, portanto sua geometria será linear. Observe na figura 9, que o Cloro atrai o par de elétrons para perto de si, ficando com uma carga parcial negativa. Portanto, o momento dipolo é diferente de zero, e esta molécula é polar.
Figura 9 - Distribuição nuvem de elétrons na molécula de HCL.
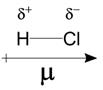

Fonte: Química na Cuca (Adaptado) 9
- Na figura 10 temos uma molécula de CO2. Observe que a molécula apresenta 3 átomos e o átomo central não possui par de elétrons emparelhados livres. Portanto, sua molécula tem geometria linear.
Figura 10 - Distribuição da nuvem eletrônica da molécula de CO2.
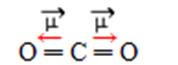
Fonte: A Graça da Química. (Adaptado) 10
Os átomos de oxigênio, mais eletronegativos, atraem o par de elétrons para perto de si, criando o mesmo momento dipolo, porém em sentidos contrários (“ponta da flecha”). Quando temos dois vetores com o mesmo módulo e direção, porém em sentidos contrários, a soma vetorial é igual a zero. Nesse caso, não haverá a criação de polos na molécula, pois a nuvem eletrônica estará igualmente distribuída entre os dois átomos de oxigênio. Portanto, o momento dipolo é igual a zero, sendo esta uma molécula apolar.
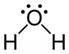
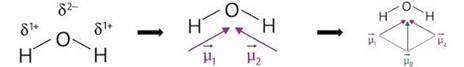
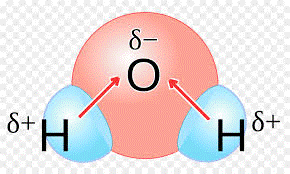
Na figura 11 temos uma molécula de água. Observe que a molécula apresenta 3 átomos e o átomo central possui par de elétrons livres, portanto sua geometria é angular.
Figura 11 - Distribuição da nuvem eletrônica da molécula de H2O.![]()
![]()
![]()
![]()
![]()
![]()
Fonte: Grátis PNG (Adaptado) 11
Observe que o oxigênio atrai o par de elétrons da ligação. Ficando com carga parcial (δ2-). Assim, ao fazermos a soma vetorial o vetor resultante será diferente de zero. Portanto, a água é uma substância polar.
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Solubilidade
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Polaridade. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/polaridade.html. Acesso em: [data de acesso].
Quando misturamos duas substâncias diferentes e elas formam uma mistura homogênea, dizemos que elas são solúveis entre si.
A tendência (não é uma regra, portanto sujeita à exceções) para a solubilidade das substâncias é:
- Substância polar dissolve (se mistura) substância polar.
- Substância apolar dissolve substância apolar.
Em outras palavras: substâncias semelhantes dissolvem substâncias semelhantes.
Exemplos:
Uma molécula de álcool que possui uma parte de sua cadeia apolar, dissolve a gasolina ,apolar.
Uma molécula de água, polar, dissolve uma molécula de glicose (açúcar) que possui inúmeros grupos polares em sua cadeia.
Uma molécula de água, polar, não se mistura com óleo, composta de moléculas de ácidos graxos, que é apolar (também possui uma pequena parte polar em sua cadeia) na sua cadeia.
Na figura 12, podemos observar claramente a imiscibilidade entre duas substâncias de polaridades opostas.
Figura 12 - Mistura de dois líquidos de polaridades distintas.

Fonte: Wikimedia Commons 12
Tensoativos
Tensoativo ou surfactante é um tipo de molécula que apresenta uma parte com característica apolar ligada a uma outra parte com característica polar, que é responsável pela solubilidade da molécula em água. São amplamente utilizados na indústria de cosméticos e limpeza em produtos com sabões, detergentes, xampus e sabonetes.
Devido às suas estruturas e propriedades, substâncias tensoativas em presença de uma fase orgânica (como um óleo) e uma fase aquosa, absorvem-se nas interfaces orientando-se de maneira que o grupo polar fique voltado para a fase aquosa e o grupo apolar para a fase orgânica, formando um filme molecular ordenado nas interfaces, reduzindo assim as tensões interfacial e superficial.
Na figura 13 temos uma representação dos quatro tipos de tensoativos existentes. A cabeça hidrofílica é a parte que interage com a água polar. Já a cauda hidrofóbica é a parte que interage com as moléculas apolares.
Figura 13 - Representação de uma molécula de tensoativo.
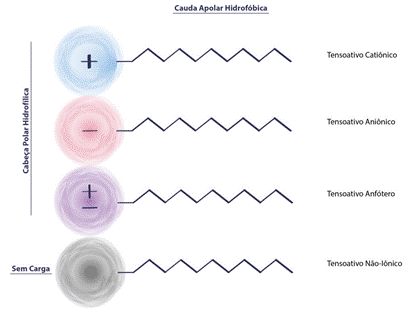
Fonte: Engenharia dos Cosméticos 13
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Forças Intermoleculares
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Polaridade. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/polaridade.html. Acesso em: [data de acesso].
Introdução
Em função de suas polaridades, moléculas podem se atrair ou repelir entre si. Essa dinâmica que ocorre entre as moléculas é chamada de interação intermolecular. Existem três tipos de força de atração intermolecular, que são nomeadas como forças de Van der Waals.
Interação Dipolo-Dipolo
A interação dipolo-dipolo, também chamada de dipolo permanente-dipolo permanente, está relacionada à orientação dos dipolos das moléculas quando estas interagem entre si. De maneira geral o pólo de carga parcial positiva de uma molécula atrai o pólo de carga parcial negativa de outra, e isso se repete inúmeras vezes entre as diversas moléculas de um sistema (Figura 14).
Figura 14 - Força de atração intermolecular dipolo-dipolo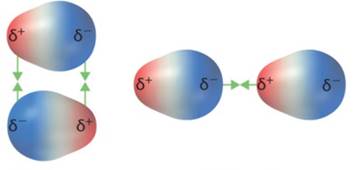
Fonte: Eduardo Santos de Araújo ([20--?] 14
Ligações de Hidrogênio
As ligações de hidrogênio envolvem moléculas polares onde um átomo de um elemento muito eletronegativo de uma molécula (flúor, oxigênio ou nitrogênio) atrai o átomo de hidrogênio (que é pouco eletronegativo) de outra. Dentre as demais forças intermoleculares, as ligações de hidrogênio são as mais fortes.
Essa alta intensidade de interação ocorre devido à conjunção de dois fatores: a alta polaridade gerada pela interação H-FON (hidrogênio com flúor, oxigênio ou nitrogênio) é somada ao fato de que o hidrogênio, por ser o menor elemento da tabela periódica, permite uma interação muito próxima entre as moléculas (figura 15).
Figura 15 - Representação esquemática das Ligações de hidrogênio na água
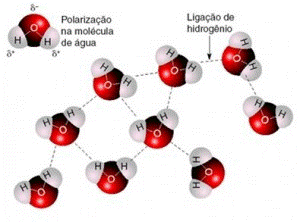
Fonte: Paula (2016) 15
São exemplos de moléculas que interagem formando ligações de hidrogênio: água (H2O), fluoreto de hidrogênio (HF) e amônia (NH3).
Dipolo instantâneo - Dipolo induzido
Embora não possuam polos, as moléculas apolares ainda interagem entre si, isso porque os elétrons dos átomos estão em constante movimento e, em um determinado momento, pode ocorrer de um lado da molécula se encontrar com mais elétrons do que o outro, surgindo um dipolo elétrico momentâneo. Este “dipolo instantâneo” surgido induz em outra molécula apolar o surgimento de um dipolo (figura 16), caracterizando uma interação intermolecular.
Figura 16 - Atração intermolecular entre moléculas apolares
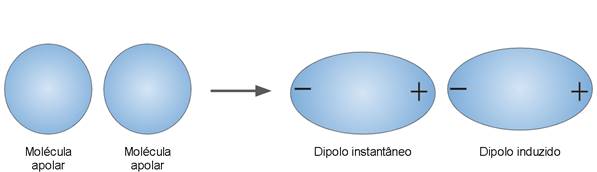
Fonte:Paula (2016, Adaptado) 16
Você sabia? A matéria no estado sólido e líquido existe devido às forças intermoleculares que agem entre os compostos. Se não existisse esse tipo de interação, todas as substâncias estariam no estado gasoso. |
Intensidade das Forças Intermoleculares
Estabelecendo um comparativo entre moléculas de massas parecidas para cada tipo de interação intermolecular, pode-se afirmar que as Ligações de Hidrogênio são as interações mais fortes, seguida da interação dipolo-dipolo e por último tem-se as interações dipolo instantâneo-dipolo induzido.

Ponto de ebulição
Quando estudamos os estados da matéria, vimos que o estado gasoso é definido pelo movimento desordenado das moléculas que formam a substância. De fato, este movimento desordenado e rápido só é possível devido à ausência de interação intermolecular entre as partículas do gás. Portanto, quando uma substância passa do estado líquido (ou sólido) para o estado gasoso, o que ocorre é o rompimento dessa interação intermolecular entre elas (Figura 17).
Figura 17 - Moléculas passando do estado líquido para o gasoso. Note que há a quebra das interações intermoleculares.
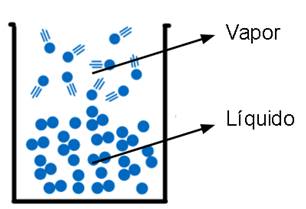
Fonte: Imagem do Autor
Vale ressaltar! |
Quanto mais intensa for a interação entre as moléculas do composto, mais energia será necessária para o rompimento da ligação intermolecular entre elas, isto é, maior será seu ponto de ebulição. Quando a interação for dipolo instantâneo-dipolo induzido, que é considerada fraca, o ponto de ebulição do composto será baixo se comparado à outra substância cuja interação intermolecular seja dipolo-dipolo. Por fim, as ligações de hidrogênio fazem com que os pontos de ebulição sejam ainda maiores, tendo em vista sua altíssima intensidade. Essa ideia fica evidenciada no gráfico da figura 18.
Figura 18 - Ponto de ebulição dos hidretos dos grupos 14 à 17.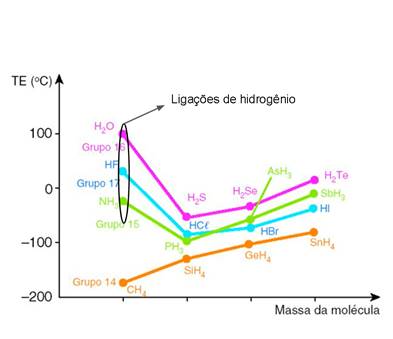
Fonte: Thalita Bermudes, ([20--?], Adaptado) 17
É importante notar também que, quando compara-se substâncias moleculares que estabelecem o mesmo tipo de interação intermolecular, quanto maior for a massa da substância, maior será seu ponto de ebulição.
Moléculas |
Dipolo elétrico |
Tipo de interação |
Intensidade da interação |
Ponto de ebulição |
|
|
Dipolo-dipolo |
Intermediário |
Intermediário |
Polar |
Apresentam |
Ligações de hidrogênio |
Forte |
Alto |
Apolar |
Não apresentam |
Dipolo instantâneo- Dipolo induzido |
Fraca |
Baixo |
É isso aí! Finalizamos o capítulo sobre Polaridade e Forças Intermoleculares. E aí, pronto para resolvermos alguns exercícios? |
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
.
Exercícios
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Polaridade. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/polaridade.html. Acesso em: [data de acesso].
1) (ENEM-2016) O carvão ativado (C) é um material que possui elevado teor de carbono, sendo muito utilizado para a remoção de compostos orgânicos voláteis do meio, como o benzeno (C6H6). Para a remoção desses compostos, utiliza-se a adsorção. Esse fenômeno ocorre por meio de interações do tipo intermoleculares entre a superfície do carvão (adsorvente) e o benzeno (adsorvato, substância adsorvida).
No caso apresentado, entre o adsorvente e a substância adsorvida ocorre a formação de:
A) Ligações dissulfeto.
B) Ligações covalentes.
C) Ligações de hidrogênio.
D) Interações dipolo induzido – dipolo induzido.
E) Interações dipolo permanente – dipolo permanente.
2) (Mackenzie) Analise as seguintes informações:
I. A molécula CO2 é apolar, sendo formada por ligações covalentes polares.
II. A molécula H2O é polar ,sendo formada por ligações covalentes apolares.
III. A molécula NH3 é polar, sendo formada por ligações iônicas
Concluí se que:
a) somente I é correta.
b) somente II é correta.
c) somente III é correta.
d) somente II e III são corretas.
e) somente I e III são corretas.
3) (UFC - CE) Uma pesquisa publicada na revista Nature (Ano: 2000, vol.405, pg. 681,) mostrou que a habilidade das lagartixas (víboras) em escalar superfícies lisas como uma parede, por exemplo, é resultado de interações intermoleculares. Admitindo que a parede é recoberta por um material apolar e encontra‐se seca, assinale a alternativa que classifica corretamente o tipo de interação que prevalece entre as lagartixas e a parede, respectivamente:
A) íon – íon.
B) íon – dipolo permanente.
C) dipolo induzido – dipolo induzido.
D) dipolo permanente – dipolo induzido.
E) dipolo permanente – dipolo
4) (ENEM 2016) Os tensoativos são compostos capazes de interagir com substâncias polares e apolares. A parte iônica dos tensoativos interage com substâncias polares, e a parte lipofílica interage com as apolares. A estrutura orgânica de um tensoativo pode ser representada por:
.png)
Ao adicionar um tensoativo sobre a água, suas moléculas formam um arranjo ordenado.
Esse arranjo é representado esquematicamente por:
A) .png)
B) .png)
C) .png)
D) .png)
E) .png)
5) (ENEM-2018) Partículas microscópicas existentes na atmosfera funcionam como núcleos de condensação de vapor de água que, sob condições adequadas de temperatura e pressão, propiciam a formação das nuvens e consequentemente das chuvas. No ar atmosférico, tais partículas são formadas pela reação de ácidos (HX) com a base NH3, de forma natural ou antropogênica, dando origem a sais de amónio (NH4X), de acordo com a equação química genérica:
HX (g) + NH3 (g) » NH4X (S)
FELIX, E. P.; CARDOSO, A. A. Fatores ambientais que afetam a precipitação úmida. Química Nova na Escola, n. 21, maio 2005 (adaptado)
A fixação de moléculas de vapor de água pelos núcleos de condensação ocorre por:
A) ligações iônicas.
B) interações dipolo-dipolo.
C) interações dipolo-dipolo induzido.
D) interações íon-dipolo.
E) ligações covalentes.
6) (ENEM-2015) Pesticidas são substâncias utilizadas para promover o controle de pragas. No entanto, após sua aplicação em ambientes abertos, alguns pesticidas organoclorados são arrastados pela água até lagos e rios e, ao passar pelas guelras dos peixes, podem difundir-se para seus tecidos lipídicos e lá se acumularem. A característica desses compostos, responsável pelo processo descrito no texto, é o(a)
a) baixa polaridade.
b) baixa massa molecular.
c) ocorrência de halogênios.
d) tamanho pequeno das moléculas.
e) presença de hidroxilas nas cadeias.
7) (ENEM-2012) Quando colocados em água, os fosfolipídios tendem a formar lipossomos, estruturas formadas por uma bicamada lipídica, conforme mostrado na figura. Quando rompida, essa estrutura tende a se reorganizar em um novo lipossomo. Esse arranjo característico se deve ao fato de os fosfolipídios apresentarem uma natureza
.png)
A) polar, ou seja, serem inteiramente solúveis em água.
B) apolar, ou seja, não serem solúveis em solução aquosa.
C) anfotérica, ou seja, podem comportar-se como ácidos e bases.
D) insaturada, ou seja, possuírem duplas ligações em sua estrutura.
E) anfifílica, ou seja, possuírem uma parte hidrofílica e outra hidrofóbica.
8) (Fuvest-2007) A figura mostra modelos de algumas moléculas com ligações covalentes entre seus átomos.
Analise a polaridade dessas moléculas, sabendo que tal propriedade depende da
- diferença de eletronegatividade entre os átomos que estão diretamente ligados. (Nas moléculas apresentadas, átomos de elementos diferentes têm eletronegatividades diferentes.)
- forma geométrica das moléculas.
(Observação: Eletronegatividade é a capacidade de um átomo para atrair os elétrons da ligação covalente.)
Dentre essas moléculas, pode-se afirmar que são polares apenas
a) A e B
b) A e C
c) A, C e D
d) B, C e D
e) C e D
9) (Vunesp-SP) Considere as afirmações:
I- Comparando duas substâncias com o mesmo tipo de interação intermolecular, a que possuir maior massa molecular possuirá maior ponto de ebulição.
II- Comparando duas substâncias com massas molares próximas, a que possui forças intermoleculares mais intensas possuir a maior ponto de ebulição.
III- O ponto de ebulição é prioridade específica de uma substância.
Está correto o contido em:
a) I apenas
b) II apenas
c) III apenas
d) I e II apenas
e) I, II, e III
Bibliografia Consultada
ARAÚJO, Eduardo Santos de. Forças Intermoleculares. Guarapuava, [20--?]. 17 slides. Disponível em: 18
O QUE você deve saber sobre ligações químicas. Publicado por Thalita Bermudes. [S.l]: UNO Digital, [20--?]. 1 vídeo (12 min). Disponível em: 19
PAULA, Camila. Quais são as principais forças intermoleculares?, Descomplica, 20 mar. 2016. 20
REIS, Martha. Química: meio ambiente, cidadania e tecnologia. São Paulo: FTD, 2010. p. 281- 298. v. 1.
UNIDADE: Estados da matéria e forças intermoleculares. Khan Academy, [20--]. Disponível em: 21
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
.png)
