
Modelos Atômicos
IFSP - Cursinho Popular
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Modelos atómicos. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/modelos-atomicos.html. Acesso em: [data de acesso].
Tópicos: Contextualização; Modelo atômico de Dalton; Modelo atômico de Thomson; Modelo atômico de Rutherford; Modelo atômico de Böhr; Modelo atômico Moderno; Questões. Os conhecimentos sobre os
são muito importantes, pois eles tentam explicar sobre o comportamento dos átomos e como a matéria é construída e organizada. Isso é essencial para que possamos entender melhor como ocorrem os fenômenos da natureza dos quais nos deparamos diariamente.Contextualização
Ao longo da história, os seres humanos sempre se questionaram e continuam se perguntando: De onde viemos? Para onde vamos? Qual o sentido da vida? Do que somos feitos?
Essa última pergunta é o objeto de estudo da chamada
Hoje sabemos que tudo no universo é constituído por átomos; contudo, esse conhecimento só foi desenvolvido ao longo de muitos séculos, e é o que veremos neste capítulo.
A concepção da existência de átomos é bem mais antiga do que se pensa. O filósofo grego Demócrito (460-370 a.C.), por exemplo, acreditava que se dividíssemos algo em pedaços cada vez menores chegaria um momento em que teríamos uma partícula elementar indivisível, chamada
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Modelo Atômico de Dalton
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Modelos atómicos. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/modelos-atomicos.html. Acesso em: [data de acesso].
Depois da ideia de átomo criada na Grécia antiga por Demócrito, isso foi deixado de lado durante um longo tempo. Somente no século XIX, com o físico inglês (1776-1884), esse modelo proposto por Demócrito é retomado e incrementado. Ele analisou os resultados dos experimentos realizados pelos cientistas e .
Essas experiências propunham um caráter mais racional para os fenômenos químicos e físicos observados. O modelo atômico de Dalton trata-se da primeira tentativa de explicar o átomo de maneira científica. Para Dalton:
- O átomo era uma esfera maciça e indivisível;
- Toda matéria é formada por átomos, partículas indivisíveis;
- Átomos de um mesmo elemento são iguais em massa e propriedades;
- Átomos de elementos diferentes têm distintas massa e propriedades;
- Os compostos são formados de átomos que se combinam em proporções simples: 1:2, 1:3, 1:4, etc.
Esse modelo atômico de Dalton também é popularmente conhecido como “bola de bilhar” e pode ser visualizado na figura 1.
Figura 1 - Modelo atômico proposto por John Dalton

Fonte: Wikimedia Commons 8
O modelo de Dalton permite uma reflexão ainda maior. Como a definição do conceito de REAÇÃO QUÍMICA. Aqui podemos definir como o rearranjo dos átomos, por isso ele consegue explicar a lei de conservação das massas e as proporções definidas.
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Modelo atômico de Thomson
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Modelos atómicos. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/modelos-atomicos.html. Acesso em: [data de acesso].
No final do século XIX o físico inglês (1856- 1940) começou a fazer experimentos com , também conhecido como ampola de Crookes. Quando um gás rarefeito, em baixa pressão, é submetido a uma alta voltagem elétrica, produz um feixe de partículas (composto por cargas elétricas) que vai do ao . Seu nome “tubos de raios catódicos” se deve justamente ao fato dos feixes partirem do cátodo.
Para testar as propriedades das partículas, o procedimento realizado por Thomson foi basicamente o seguinte: ele colocou campos elétricos e magnéticos na região externa à ampola de Crookes e observou que, ao serem submetidos a esses campos, os raios catódicos sofreram um desvio na sua trajetória, indo em direção ao pólo positivo, indicando que os raios catódicos eram compostos de partículas carregadas negativamente. O raio catódico era percebido graças a uma tela recoberta de fósforo que foi colocada na extremidade do tubo, que emite luz ao serem atingidas. O esquema do experimento realizado pode ser visualizado na figura 2.
Figura 2 - Esquema do experimento feito por Thomson.
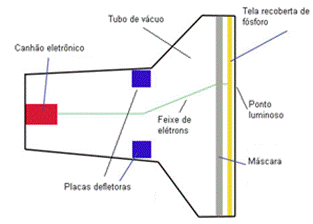
Fonte: Instituto NCB 6.
Com os resultados experimentais, Thomson descobriu que a carga e massa das partículas apresentam-se muito inferior à do átomo mais leve conhecido. Verificou, também, que essas propriedades permaneciam inalteradas independente dos metais utilizados no eletrodo ou do gás dentro do tubo. Partindo destas evidências experimentais, Thomson chegou às seguintes conclusões:
- O raio catódico é composto de partículas carregadas negativamente, que ele chamou de “elétron”;
- Os elétrons compõem o átomo, pois a massa de cada partícula é apenas 1/1836 da massa de um átomo de hidrogênio (elemento com menor massa atômica);
- Todos os elementos possuem essas partículas.
Portanto, para Thomson o átomo:
- Era divisível (diferentemente do que afirmara Dalton);
- Apresentava cargas positivas proporcionalmente às cargas negativas, para que a carga final fosse nula, visto que o átomo é neutro;
- Pode ser considerado como um fluido contínuo de cargas positivas onde estariam distribuídos os elétrons.
Seu modelo atômico é associado a um pudim de passas, em que o pudim seria a parte positiva, e as passas seriam a parte negativa com os elétrons uniformemente distribuídos na superfície (devido a repulsão dos elétrons, já que possuem a mesma carga). Seu modelo proposto, pode ser visualizado na figura 3.
Figura 3 - Modelo atômico proposto por Thomson.
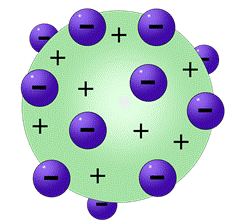
Fonte: Pixabay 7.
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Modelo Atômico de Rutherford
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Modelos atómicos. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/modelos-atomicos.html. Acesso em: [data de acesso].
Em 1911 o físico neozelandês fez o segundo experimento mais revolucionário da história do átomo, com o objetivo de aperfeiçoar o modelo atômico proposto por Thomson. Rutherford desconfiava que o modelo atômico de Thomson poderia possuir falhas, especialmente por questões que envolviam a radioatividade. Em seu experimento (que na verdade foi realizado por dois de seus alunos, Geiger e Mardsen), Rutherford bombardeou uma folha bem fina de ouro com feixe de . Rutherford colocou uma amostra de rádio (um metal radioativo) dentro de uma caixa feita de chumbo que possuía uma pequena abertura. Apesar do chumbo ter absorvido a maior parte da radiação, um feixe fino de partículas alfa passou pela abertura, indo em direção à folha de ouro, atingindo-a.
Para detectar se as partículas alfa se chocariam com a lâmina de ouro, a mesma foi recoberta com uma tela detectora composta de um filme fluorescente de sulfeto de zinco (ZnS), uma vez que ocorreria emissão de luz toda vez que a partícula alfa se chocasse contra esse filme, provocando uma mancha no ponto.
Baseado no que propunha o modelo atômico de Thomson, Rutherford esperava que a maioria das partículas alfa passariam direto pela folha de ouro pois, supunha-se, que a carga positiva ocorresse de maneira espalhada por todo o volume do átomo. Portanto, o campo elétrico do modelo atômico “pudim de passas" de carga positiva seria muito fraco a ponto de não ser capaz de afetar a rota das partículas alfa, que eram relativamente grandes e rápidas.
Contudo, os resultados do experimento foram surpreendentes e inesperados. A maioria das partículas alfa passaram direto pela folha de ouro; porém, algumas partículas sofreram desvios superiores a 90° de sua trajetória. Na figura 4 podemos observar uma comparação entre o resultado esperado segundo o modelo de Thomson e o resultado obtido experimentalmente Rutherford.
Figura 4 - Comparação entre o resultado esperado por Rutherford e o resultado obtido.
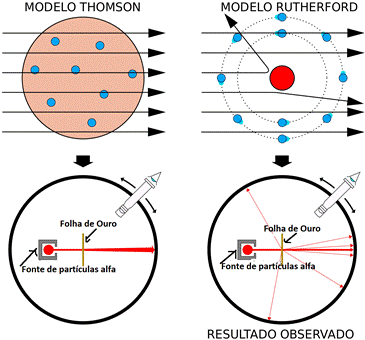
Fonte:Wikimedia Commons (Adaptado) 14
Com esses desvios sofridos por uma parcela das partículas alfa detectadas, Rutherford concluiu que o átomo deveria conter cargas positivas - ao qual chamou de prótons - localizadas em um núcleo que corresponderia a um volume bem pequeno do átomo. Percebeu, também, que esse núcleo deveria concentrar quase toda a massa do átomo e que deveria estar localizado no centro do átomo, uma vez que quando uma partícula alfa positiva atingia o núcleo positivo do átomo de ouro ela sofria repulsão e desviava. Além disso, deveria ser composto de espaço vazio em sua maior parte, visto que a maior parcela das partículas alfa não sofreram desvios em suas trajetórias.
O átomo de Rutherford tinha uma contradição, pois se um átomo apresentasse mais de uma partícula positiva teria sua estabilidade comprometida, já que elas tenderiam a se repelir no núcleo. Para resolver essa contradição, ele propôs que deveria haver partículas semelhantes aos prótons, porém com cargas elétricas nulas. Isso reduziria a repulsão sentida pelos prótons, e tornaria o átomo estável.
Portanto, Rutherford chegou às seguintes conclusões para o átomo:
- Possuía um núcleo carregado positivamente com prótons e partículas neutras parecidas com prótons, porém sem carga elétrica;
- Teria os elétrons orbitando ao redor de um núcleo em uma região conhecida como eletrosfera;
- A massa de um elétron é cerca de 1836 vezes menor que a massa de um próton;
- O núcleo concentra praticamente toda a massa atômica;
- A eletrosfera possui um raio cerca de 10 mil vezes maior que a do núcleo.
O modelo de Rutherford é conhecido como modelo planetário. Essa é uma alusão ao movimento descrito pelos elétrons em torno do núcleo, no qual assemelha-se ao movimento dos planetas em torno do Sol. Seu modelo proposto pode ser visualizado na figura 5.
Figura 5 - Modelo atômico proposto por Rutherford.
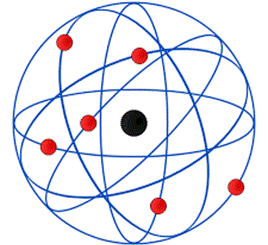
Fonte: Wikimedia Commons 13.
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Modelo Atômico de Böhr
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Modelos atómicos. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/modelos-atomicos.html. Acesso em: [data de acesso].
conferiu às órbitas dos elétrons o caráter de energia conservativa: os elétrons estariam orbitando ao redor do núcleo em níveis de energia, portanto não ganham e nem perdem energia. Analogamente, as camadas seriam como os degraus de uma escada; o elétron só pode estar em um degrau ou outro, mas nunca entre os dois. Além disso, os elétrons possuíam uma quantidade de energia específica correspondente à sua órbita, ou seja, sua energia seria quantizada.
O elétron poderia mudar de camada ou nível de energia (n). Porém, quando um elétron absorve energia, ele salta para um nível mais energético (mais distante do núcleo) e, para retornar à sua camada de origem ele deve liberar toda a energia recebida sob a forma de
, emitindo radiação eletromagnética de um comprimento específico de onda correspondente a uma cor. Isso explica os espectros discretos de radiação observados. Essa ideia tem relação com os espectros de linha, também conhecidos como série de Balmer . Essa ideia pode ser observada na figura 6.
Figura 6 - Elétron saltando para um nível mais energético, depois voltando ao seu nível de origem e liberando energia na forma de onda eletromagnética.
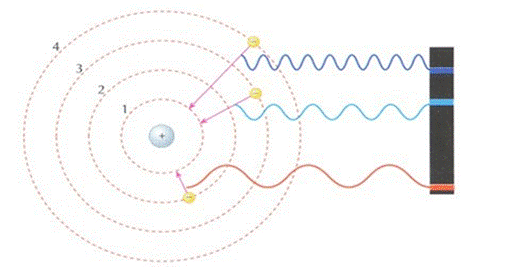
Fonte:Wikimedia Commons 15.
Quando um elétron está em sua órbita de origem, dizemos que ele está em seu estado fundamental. Se ele absorver energia e mudar de órbita, dizemos que ele está em um estado excitado. Essa ideia, também explica muito bem o funcionamento dos , por exemplo.
Bohr, então, dividiu a eletrosfera em sete camadas: K, L, M, N, O, P, Q, que possuem órbitas e raios definidos. Quanto mais perto do núcleo estiver a camada, maior será a atração com o núcleo atômico, e, portanto, menor será sua energia; quanto mais afastada, maior será sua energia.
Nível |
K (n=1) |
L(n=2) |
M(n=3) |
N(n=4) |
O(n=5) |
P(n=6) |
Q(n=7) |
N° máximo de elétrons |
2 |
8 |
18 |
32 |
32 |
8 |
18 |
Portanto, Bohr fez algumas proposições para seu modelo de átomo:
- Possui um núcleo em que os elétrons giram em órbitas circulares sem perder ou ganhar energia (energia quantizada);
- Os elétrons só podem orbitar por uma camada ou outra, nunca entre essas camadas;
- O elétron pode mudar para uma órbita mais externa (se absorver energia) ou para uma órbita mais interna (ao emitir energia).
Seu modelo proposto pode ser visualizado na figura 7.
Figura 7 - Modelo atômico proposto por Bohr.
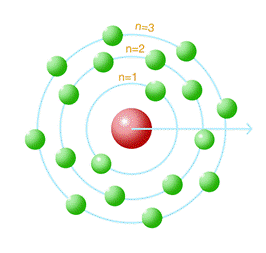
Fonte: Pixabay 16.
Por se tratar de um aperfeiçoamento do modelo atômico de Rutherford, o modelo atômico de Böhr também é conhecido como modelo atômico de “Rutherford- Böhr”.
O modelo atômico de Bohr também era impreciso, pois só funcionou para explicar o espectro descontínuo de emissão do hidrogênio e de elementos hidrogenóides (que tem apenas 1 elétron).Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Modelo atômico moderno
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Modelos atómicos. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/modelos-atomicos.html. Acesso em: [data de acesso].
O modelo atômico atual, também conhecido como modelo atômico da mecânica quântica, resulta do aprimoramento de modelos atômicos anteriores.
Em 1916, o cientista acrescentou um detalhe ao átomo de Rutherford-Bohr ao afirmar que as órbitas não eram circulares, mas sim elípticas. Portanto, teria momentos em que o elétron estaria mais próximo do núcleo, e, em outros, mais distante. Assim, sua velocidade também sofreria variação.
Em 1923, estabeleceu o princípio da dualidade, que estendeu o conceito de dualidade onda-partícula para os corpos materiais. Sua hipótese era de que o comportamento de onda–partícula da radiação, constatadas pelos experimentos fotoelétricos de Einstein, também se aplicava aos corpos materiais. Ele dizia que quanto menor a massa, mais explícito seria o comportamento de onda. Dessa forma, assim como os fótons, os elétrons que possuíam uma massa muito pequena, também apresentariam comportamento de onda. Isso significa que o elétron poderia se comportar como onda ou partícula, mas nunca os dois ao mesmo tempo. Da mesma forma que os fótons têm associado a ele uma onda luminosa que determina seu movimento, o elétron teria a ele uma onda de matéria que determina seu movimento.
Em 1926, o físico estabeleceu o princípio da incerteza. Segundo esse princípio, devido ao movimento complexo do elétron, não seria possível saber com precisão sua velocidade e sua localização na eletrosfera simultaneamente, ou seja, essas variáveis seriam incertas. Ele admite que um átomo possui elétrons movimentando-se em torno de um núcleo. Tal movimento não pode ser completamente descrito, uma vez que as trajetórias dos elétrons são incertas. Contudo, podemos calcular a probabilidade de encontrar os elétrons em regiões determinadas ao redor do núcleo atômico.
Em 1926, o cientista estabeleceu as equações de função de onda. Através delas seria possível deduzir com a máxima probabilidade a região onde um elétron estaria localizado. Essa região é chamada de orbital. Esses orbitais foram distribuídos em subníveis: s, p, d, f.
Subnível |
s |
p |
d |
f |
N° orbitais |
1 |
3 |
5 |
7 |
Em 1932, o cientista comprovou a suspeita de Rutherford de que haveriam partículas neutras dentro do núcleo atômico. Ele fez um experimento no qual ele bombardeou uma amostra de berílio radioativo com feixes de partículas alfa. Ele percebeu que após a colisão eram emitidas partículas neutras. Após fazer seus cálculos, percebeu que a massa dessas partículas era praticamente igual a massa dos prótons. Logo, ele confirmou a tese de Rutherford de que haviam partículas eletricamente neutras e com massa parecida ao do próton no interior do núcleo. Ele chamou essa partícula de nêutron.
No átomo moderno:
- O núcleo é composto de prótons e nêutrons;
- Não é possível saber com precisão a velocidade e a localização de um elétron na eletrosfera, somente a probabilidade de encontrarmos em determinada região;
- A região com a máxima probabilidade de se encontrar um elétron é chamada de subnível;
- Elétron apresenta “dupla identidade”, pode se comportar como onda ou como partícula.
O modelo atômico atual está representado na figura 8.
Figura 8 - Representação do átomo moderno.
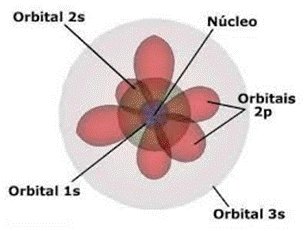
Fonte: Mundo Educação 17.
Parabéns!!! Agora que você está manjando tudo sobre modelos atômicos, recomendamos que vocês resolvam as questões propostas a seguir, para uma melhor fixação dos conhecimentos obtidos. |
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Exercícios
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Modelos atómicos. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/modelos-atomicos.html. Acesso em: [data de acesso].
1) (ENEM/2019) Um teste de laboratório permite identificar alguns cátions metálicos ao introduzir uma pequena quantidade do material de interesse em uma chama de bico de Bunsen para, em seguida, observar a cor da luz emitida. A cor observada é proveniente da emissão de radiação eletromagnética ao ocorrer a
A) mudança da fase sólida para a fase líquida do elemento metálico.
B) combustão dos cátions metálicos provocada pelas moléculas de oxigênio da atmosfera.
C) diminuição da energia cinética dos elétrons em uma mesma órbita na eletrosfera atômica.
D) transição eletrônica de um nível mais externo para outro mais interno na eletrosfera atômica.
E) promoção dos elétrons que se encontram no estado fundamental de energia para níveis mais energéticos.
2) (ENEM/2019) Em 1808, Dalton publicou o seu famoso livro intitulado Um novo sistema de filosofia química (do original A New System of Chemical Philosophy), no qual continha os cinco postulados que serviam como alicerce da primeira teoria atômica da matéria fundamentada no método científico. Esses postulados são numerados a seguir: 1. A matéria é constituída de átomos indivisíveis. 2. Todos os átomos de um dado elemento químico são idênticos em massa e em todas as outras propriedades. 3. Diferentes elementos químicos têm diferentes tipos de átomos; em particular, seus átomos têm diferentes massas. 4. Os átomos são indestrutíveis e nas reações químicas mantém suas identidades. 5. Átomos de elementos combinam com átomos de outros elementos em proporções de números inteiros pequenos para formar compostos. Após o modelo de Dalton, outros modelos baseados em outros dados experimentais evidenciaram, entre outras coisas, a natureza elétrica da matéria, a composição e organização do átomo e a quantização da energia no modelo atômico. OXTOBY, D. W.; GILLIS, H. P.; BUTLER, L. J. Principles of Modern Chemistry. Boston: Cengage Learning, 2012 (adaptado). Com base no modelo atual que descreve o átomo, qual dos postulados de Dalton ainda é considerado correto? A)1 B)2 C) 3 D)4 E) 5
3) (ITA - SP/1999) Em 1803, John Dalton propôs um modelo de teoria atômica. Considere que sobre a base conceitual desse modelo sejam feitas as seguintes afirmações:
I- O átomo apresenta a configuração de uma esfera rígida;
II- Os átomos caracterizam os elementos químicos e somente os átomos de um mesmo elemento são idênticos em todos os aspectos;
III- As transformações químicas consistem de combinação, separação e/ou rearranjo de átomos;
IV- Substâncias compostas são formadas de átomos de dois ou mais elementos unidos em uma razão fixa.
Qual das opções a seguir se refere a todas as afirmações CORRETAS?
A) I e II
B) II e III
C) II e IV
D) II,III e IV
E) I, II, III e IV
4) (Unb – DF) Um importante cientista na evolução do conhecimento químico foi John Dalton (1766-1844). Com base nos trabalhos de Lavoisier, de Proust (1754-1826) e de outros cientistas da época, Dalton resgatou os conceitos acerca da indivisibilidade do átomo introduzidos por Demócrito e Leucipo, filósofos gregos que tiveram suas idéias rejeitadas por Platão e Aristóteles, influentes filósofos na época (400 a.C.). A teoria atômica, como ficou conhecido o conjunto de proposições de Dalton para explicar as leis da Química na época aceitas, foi importante para o desenvolvimento dos conceitos químicos. A esse respeito, assinale as afirmações corretas acerca da Teoria de Dalton.
y
A) O modelo atômico de Dalton não é suficiente para explicar a estequiometria das reações químicas.
B) De acordo com o modelo proposto por Dalton, todos os átomos de um mesmo elemento apresentam as mesmas propriedades químicas.
C) A concepção de átomo indivisível, defendida por Dalton, é cientificamente válida até hoje.
D) De acordo com Dalton, átomos não podem ser criados ou destruídos no curso de reações químicas ordinárias.
5) (Univali-SC) Há exatos 100 anos, J.J Thomson determinou, pela primeira vez, a relação entre a massa e a carga do elétron, o que pode ser considerado como a descoberta do elétron. É reconhecida como uma contribuição de Thomson ao modelo atômico:
a) o átomo ser indivisível;
b) a existência de partículas subatômicas;
c) os elétrons ocuparem níveis discretos de energia;
d) os elétrons girarem em órbitas circulares ao redor do núcleo;
e) o átomo possuir um núcleo com carga positiva e uma eletrosfera.
6) (PUC-RS/2007) Um experimento conduzido pela equipe de Rutherford consistiu no bombardeamento de finas lâminas de ouro, para estudo de desvios de partículas alfa. Rutherford pôde observar que a maioria das partículas alfa atravessava a fina lâmina de ouro, uma pequena parcela era desviada de sua trajetória e uma outra pequena parcela era refletida. Rutherford então idealizou um outro modelo atômico, que explicava os resultados obtidos no experimento. Em relação ao modelo de Rutherford, afirma-se que:
I. o átomo é constituído por duas regiões distintas: o núcleo e a eletrosfera.
II. o núcleo atômico é extremamente pequeno em relação ao tamanho do átomo.
III. os elétrons estão situados na superfície de uma esfera de carga positiva.
IV. os elétrons movimentam-se ao redor do núcleo em trajetórias circulares, denominados níveis, com valores determinados de energia.
As afirmativas corretas são, apenas:
a) I e II
b) I e III
c) II e IV
d) III e IV
e) I, II e III
7) (PUC-MG/2007) Assinale a afirmativa que descreve ADEQUADAMENTE a teoria atômica de Dalton. Toda matéria é constituída de átomos:
a) os quais são formados por partículas positivas e negativas.
b) os quais são formados por um núcleo positivo e por elétrons que gravitam livremente em torno desse núcleo.
c) os quais são formados por um núcleo positivo e por elétrons que gravitam em diferentes camadas eletrônicas.
d) e todos os átomos de um mesmo elemento são idênticos.
8) - (UNESP SP/2016) A luz branca é composta por ondas eletromagnéticas de todas as frequências do espectro visível. O espectro de radiação emitido por um elemento, quando submetido a um arco elétrico ou a altas temperaturas, é descontínuo e apresenta uma de suas linhas com maior intensidade, o que fornece “uma impressão digital” desse elemento. Quando essas linhas estão situadas na região da radiação visível, é possível identificar diferentes elementos químicos por meio dos chamados testes de chama.
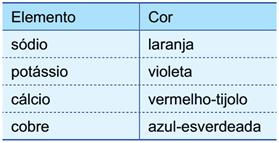
A tabela apresenta as cores características emitidas por alguns elementos no teste de chama: Em 1913, Niels Bohr (1885-1962) propôs um modelo que fornecia uma explicação para a origem dos espectros atômicos. Nesse modelo, Bohr introduziu uma série de postulados, dentre os quais, a energia do elétron só pode assumir certos valores discretos, ocupando níveis de energia permitidos ao redor do núcleo atômico. Considerando o modelo de Bohr, os diferentes espectros atômicos podem ser explicados em função
a) do recebimento de elétrons por diferentes elementos.
b) da perda de elétrons por diferentes elementos.
c) das diferentes transições eletrônicas, que variam de elemento para elemento.
d) da promoção de diferentes elétrons para níveis mais energéticos.
e) da instabilidade nuclear de diferentes elementos
9) (UEL PR/2015) De onde vem o mundo? De onde vem o universo? Tudo o que existe tem que ter um começo. Portanto, em algum momento, o universo também tinha de ter surgido a partir de uma outra coisa. Mas, se o universo de repente tivesse surgido de alguma outra coisa, então essa outra coisa também devia ter surgido de alguma outra coisa algum dia. Sofia entendeu que só tinha transferido o problema de lugar. Afinal de contas, algum dia, alguma coisa tinha de ter surgido do nada. Existe uma substância básica a partir da qual tudo é feito? A grande questão para os primeiros filósofos não era saber como tudo surgiu do nada. O que os instigava era saber como a água podia se transformar em peixes vivos, ou como a terra sem vida podia se transformar em árvores frondosas ou flores multicoloridas.
(Adaptado de: GAARDER, J. O Mundo de Sofia. Trad. de João Azenha Jr. São Paulo: Companhia das Letras, 1995. p.43-44.)
Gaarder discute a questão da existência de uma “substância básica”, a partir da qual tudo é feito. Considerando o átomo como “substância básica”, atribua V (verdadeiro) ou F (falso) às afirmativas a seguir.
( ) De acordo com o modelo atômico de Rutherford, o átomo é constituído por duas regiões distintas: o núcleo e a eletrosfera.
( ) Thomson propôs um modelo que descrevia o átomo como uma esfera carregada positivamente, na qual estariam incrustados os elétrons, com carga negativa.
( ) No experimento orientado por Rutherford, o desvio das partículas alfa era resultado da sua aproximação com cargas negativas presentes no núcleo do átomo.
( ) Ao considerar a carga das partículas básicas (prótons, elétrons e nêutrons), em um átomo neutro, o número de prótons deve ser superior ao de elétrons.
( ) Os átomos de um mesmo elemento químico devem apresentar o mesmo número atômico.
Assinale a alternativa que contém, de cima para baixo, a sequência correta.
a) V, V, F, F, V.
b) V, F, V, F, V.
c) V, F, F, V, F.
d) F, V, V, V, F.
e) F, F, F, V, V.
10) (UFPR/2014) As teorias atômicas vêm se desenvolvendo ao longo da história. Até o início do século XIX, não se tinha um modelo claro da constituição da matéria. De lá até a atualidade, a ideia de como a matéria é constituída sofreu diversas modificações, como se pode observar no modelo atômico de Bohr, que manteve paradigmas conceituais sobre a constituição da matéria, mas também inseriu novos conceitos surgidos no início do século XX.
No modelo atômico de Bohr:
1. O elétron circula em órbita com raio definido.
2. O elétron é descrito por uma função de onda.
3. Para descrever o elétron num orbital são necessários 4 números quânticos.
4. Toda a massa do átomo está concentrada no núcleo, que ocupa uma porção ínfima do espaço.
Entre as afirmativas acima, correspondem ao modelo atômico de Bohr:
a) 1 e 2 apenas.
b) 2 e 3 apenas.
c) 2, 3 e 4 apenas.
d) 1 e 4 apenas.
e) 1, 3 e 4 apenas.
11) (UNESP SP/2014) Em 2013 comemora-se o centenário do modelo atômico proposto pelo físico dinamarquês Niels Bohr para o átomo de hidrogênio, o qual incorporou o conceito de quantização da energia, possibilitando a explicação de algumas propriedades observadas experimentalmente. Embora o modelo atômico atual seja diferente, em muitos aspectos, daquele proposto por Bohr, a incorporação do conceito de quantização foi fundamental para o seu desenvolvimento. Com respeito ao modelo atômico para o átomo de hidrogênio proposto por Bohr em 1913, é correto afirmar que:
a) o espectro de emissão do átomo de H é explicado por meio da emissão de energia pelo elétron em seu movimento dentro de cada órbita estável ao redor do núcleo do átomo.
b) o movimento do elétron ao redor do núcleo do átomo é descrito por meio de níveis e subníveis eletrônicos.
c) o elétron se move com velocidade constante em cada uma das órbitas circulares permitidas ao redor do núcleo do átomo.
d) a regra do octeto é um dos conceitos fundamentais para ocupação, pelo elétron, das órbitas ao redor do núcleo do átomo.
e) a velocidade do elétron é variável em seu movimento em uma órbita elíptica ao redor do núcleo do átomo.
12) - (IFSC/2015) A Química é a ciência que estuda os átomos, sua estrutura e as suas interações. Um modelo atômico básico considera que ele pode ser dividido em duas regiões distintas denominadas núcleo e eletrosfera.
Sobre o átomo e seus constituintes, assinale no cartão-resposta a soma da(s) proposição(ões) CORRETA(S).
01. O átomo é a menor unidade da matéria, sendo indivisível.
02. A eletrosfera é a região periférica ao redor do núcleo e contém apenas os elétrons e os fótons.
04. Orbital é a região da eletrosfera onde é máxima a probabilidade de encontrar um determinado elétron.
08. Prótons, nêutrons e elétrons possuem massas aproximadamente iguais.
16. Um átomo, ou grupo de átomos, pode ganhar ou perder elétrons, formando um íon.
32. O núcleo é a região central do átomo, contém dois tipos de partículas, os prótons e os nêutrons
13) - (UECE/2014) Atente para as seguintes afirmações a respeito das conclusões a que chegou Rutherford durante a experiência sobre a estrutura da matéria.
I. O átomo é constituído por duas regiões distintas: o núcleo e a eletrosfera.
II. O núcleo atômico é extremamente pequeno em relação ao tamanho do átomo.
III. O átomo tem uma região em que existe muito espaço vazio.
IV. As partículas negativas do átomo podem ter quaisquer valores de energia.
V. A eletrosfera é a região que concentra praticamente toda a massa elétrica do átomo.
No que diz respeito à estrutura da matéria, corresponde às conclusões de Rutherford o que se afirma em
a) I, II, III, IV e V.
b) I, II e III apenas.
c) III, IV e V apenas.
d) I, II e V apenas.
14) (IFGO/2014) Em 1803, John Dalton propôs um modelo para explicar o comportamento do átomo, conhecido por alguns como o “Modelo da Bola de Bilhar”. Considere que sobre a base conceitual desse modelo sejam feitas as seguintes afirmações:
I. Para Dalton, o átomo não pode ser representado como uma esfera rígida.
II. Os átomos caracterizam os elementos químicos e somente os átomos de um mesmo elemento são idênticos em todas as suas características.
III. Compostos químicos são formados de átomos de dois ou mais elementos unidos em uma razão fixa.
IV. As transformações químicas consistem de combinação, separação, rearranjo ou destruição dos átomos.
V. Este modelo é ainda bastante utilizado para o entendimento do comportamento dos gases ideais.
Estão corretas:
a) I, II e IV.
b) II, III e V.
c) II e III.
d) I, III e IV.
e) II, III e IV.
Bibliografia Consultada
ANTOINE Lavoisier. In: WIKIPÉDIA: a enciclopédia livre. [São Francisco, CA: Fundação Wikimedia], 2021. Disponível em: https://pt.wikipedia.org/wiki/Antoine_Lavoisier. Acesso em: 13 jan. 2021.
ARNOLD Sommerfeld. In: WIKIPÉDIA: a enciclopédia livre. [São Francisco, CA: Fundação Wikimedia], 2021. Disponível em: https://pt.wikipedia.org/wiki/Arnold_Sommerfeld. Acesso em: 13 jan. 2021.
BEZERRA, L.M; et. al. Química: Ensino médio 1º ano. 3 ed. São Paulo: Edições SM, 2016. p.76- 100. v. 1.
DESCOBERTA do elétron e do núcleo. Khan Academy, [20--]. Disponível em: https://pt.khanacademy.org/science/chemistry/electronic-structure-of-atoms/history-of-atomic-structure/a/daltons-atomic-theory-version-2. Acesso em: 13 jan. 2021.
DEMÓCRITO. In: WIKIPÉDIA: a enciclopédia livre. [São Francisco, CA: Fundação Wikimedia], 2021. Disponível em: https://pt.wikipedia.org/wiki/Dem%C3%B3crito. Acesso em: 13 jan. 2021.
ERNEST Rutherford. In: WIKIPÉDIA: a enciclopédia livre. [São Francisco, CA: Fundação Wikimedia], 2017. Disponível em: https://pt.wikipedia.org/wiki/Ernest_Rutherford. Acesso em: 13 jan. 2021.
ERWIN Schrödinger. In: WIKIPÉDIA: a enciclopédia livre. [São Francisco, CA: Fundação Wikimedia], 2021. Disponível em: https://pt.wikipedia.org/wiki/Erwin_Schr%C3%B6dinger . Acesso em: 13 jan. 2021.
JAMES Chadwick. In: WIKIPÉDIA: a enciclopédia livre. [São Francisco, CA: Fundação Wikimedia], 2021. Disponível em: https://pt.wikipedia.org/wiki/James_Chadwick. Acesso em: 13 jan. 2021.
JOSEPH Louis Proust. In: WIKIPÉDIA: a enciclopédia livre. [São Francisco, CA: Fundação Wikimedia], 2021. Disponível em: https://pt.wikipedia.org/wiki/Joseph_Louis_Proust. Acesso em: 13 jan. 2021.
JOHN Dalton. In: WIKIPÉDIA: a enciclopédia livre. [São Francisco, CA: Fundação Wikimedia], 2017. Disponível em:https://pt.wikipedia.org/wiki/John_Dalton. Acesso em: 13 jan. 2021.
JOSEPH Jhon Thomson. In: WIKIPÉDIA: a enciclopédia livre. [São Francisco, CA: Fundação Wikimedia], 2021. Disponível em: https://pt.wikipedia.org/wiki/Joseph_John_Thomson. Acesso em: 13 jan. 2021.
LOUIS de Broglie. In: WIKIPÉDIA: a enciclopédia livre. [São Francisco, CA: Fundação Wikimedia], 2021. Disponível em: https://pt.wikipedia.org/wiki/Louis_de_Broglie. Acesso em: 13 jan. 2021.
MODELO da mecânica quântica do átomo. Khan Academy, [20--a]. Disponível em: https://pt.khanacademy.org/science/physics/quantum-physics/quantum-numbers-and-orbitals/a/the-quantum-mechanical-model-of-the-atom. Acesso em: 13 jan. 2021.
MODELO de Bohr do hidrogênio. Khan Academy, [20--b]. Disponível em: https://pt.khanacademy.org/science/chemistry/electronic-structure-of-atoms/history-
of-atomic-structure/a/bohrs-model-of-hydrogen. Acesso em: 13 jan. 2021.
NIELS Böhr. In: WIKIPÉDIA: a enciclopédia livre. [São Francisco, CA: Fundação Wikimedia], 2017. Disponível em: https://pt.wikipedia.org/wiki/Niels_Bohr . Acesso em: 13 jan. 2021.
REIS, Martha. Química: meio ambiente, cidadania e tecnologia. São Paulo: FTD, 2010. p.117- 131. v. 1.
TEORIA atômica de Dalton. Khan Academy, [20--]. Disponível em: https://pt.khanacademy.org/science/chemistry/electronic-structure-of-atoms/history-of-atomic-structure/a/daltons-atomic-theory-version-2. Acesso em: 13 jan. 2021.
WERNER Heisenberg. In: WIKIPÉDIA: a enciclopédia livre. [São Francisco, CA: Fundação Wikimedia], 2021. Disponível em: https://pt.wikipedia.org/wiki/Werner_Heisenberg. Acesso em: 13 jan. 2021.
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021














