
Leis Ponderais
IFSP - Cursinho Popular
Como citar este documento: MASCAI, Fábio Augusto Amaral. Leis Ponderais. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/ home/materias/leis-ponderais.html. Acesso em: [data de acesso].
Introdução
Contexto histórico
No final do século XVII e começo do século XIX, houve um grande avanço da Química, pois os cientistas passaram a ser mais meticulosos, utilizando métodos científicos e cada vez mais cuidadosos com seus experimentos. Assim, surgem as leis das reações químicas que são as leis experimentais ou empíricas, resultados de experiências e comprovações feitas em laboratório.
As leis de reações químicas classificam- se em:
Leis Ponderais: dizem respeito às massas.
- Lei de conservação da massa (ou de Lavoisier)
- Lei das proporções constantes (ou de Proust)
- Lei das proporções múltiplas (ou de Dalton)
Leis Volumétricas: dizem respeito aos volumes gasosos. São as leis volumétricas de Gay-Lussac.
Iniciaremos nosso estudo com as Leis Ponderais, que trabalham com massas.Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Lei de conservação das massas ou Lei de Lavoisier
Como citar este documento: MASCAI, Fábio Augusto Amaral. Leis Ponderais. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/ home/materias/leis-ponderais.html. Acesso em: [data de acesso].
foi um químico francês que comprovou, experimentalmente a ' lei de conservação de massas' em 1785, assim por ter conseguido comprovar, essa lei recebeu o nome de 'Lei de Lavoisier', em homenagem ao seu criador.
"Na Natureza nada se cria e nada se perde, tudo se transforma"(Lavoisier, 1785).
Interpretando, poderíamos dizer que em uma reação química, a total dos é igual à massa total dos dessa reação.
Para podermos comprovar a lei de lavoisier, experimentalmente, fazemos do seguinte modo:
Unem- se dois tubos de vidro, por meio de outro tubo de vidro, como na figura:
Figura 2 - Experimento com sistema fechado
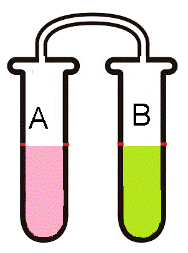
Fonte: Autoria própria
Coloca-se, separadamente em cada tubo, reagentes A e B
Fecham-se os tubos para que não exista a entrada e saída de reagentes, formando um Pesa-se o conjunto, anotando a massa Vira-se o conjunto de "cabeça para baixo", até os reagentes se misturarem completamente e completar-se a reação:Figura 3 - Experimento com sistema fechado
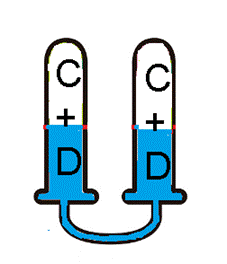
Fonte: Autoria própria
- Pesa-se novamente o conjunto, anotando a massa
- Comparamos as massas iniciais A+B com a obtida C +D
E assim, verificamos que a massa final é igual a massa inicial do conjunto.
Por exemplo: Se pegarmos 4g de H2 e reagirmos com 32g de O2 temos como produto a Água, H2O, com 36g.
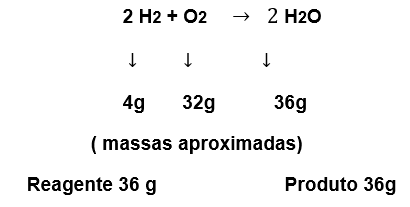
Lembrando que a reação tem que ocorrer em um sistema fechado, para que não haja interferência externa.
É interessante notar que, durante séculos, a Humanidade não tinha ideia da ocorrência da conservação de massa mesmo havendo experimentos anteriores; ninguém lembrava de manter o recipiente fechado, o que permitia que os gases pudessem "entrar" ou "sair" do sistema reacional, dando a impressão de que a massa do conjunto estaria aumentando ou diminuindo.
Como por exemplo, na combustão do carvão, como não se considerava o recipiente fechado ou aberto, a massa do conjunto sempre diminuía, uma vez que CO2 é formado e liberado em forma de gás para a atmosfera.
Figura 4 - Exemplo Experimento com sistema aberto
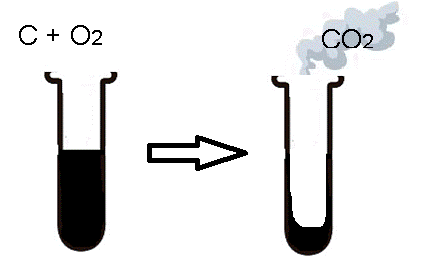
Fonte: Autoria própria
Assim, nossos antepassados acreditavam que na queima de carvão, ele sumia. Atualmente, nós conseguimos explicar esse fenômeno da seguinte maneira :
C (Carvão) + O2 (do ar) ![]() CO2 (gás carbônico)
CO2 (gás carbônico)
e, podemos comprovar experimentalmente, que a soma das massas do carvão, com a do oxigênio (fornecida pelo ar) é igual a massa final do gás carbônico formado.
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Lei das proporções constantes ou lei de Proust
Como citar este documento: MASCAI, Fábio Augusto Amaral. Leis Ponderais. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/ home/materias/leis-ponderais.html. Acesso em: [data de acesso].
foi um químico francês, que comprovou, experimentalmente, a Lei das proporções constantes, lei das proporções definidas ou Lei de Proust.Podemos entender como Lei de Proust: em uma determinada reação química, realizada em diversas experiências, a proporção entre as massas dos reagentes ou entre as massas dos produtos é constante.
Para podermos comprovar a lei de Proust, experimentalmente, fazemos do seguinte modo:
- Coletarmos água de diversos lugares (chuva, rios, mar,etc) Purificamos cada amostra de água
- Decompomos a água em seus elementos Hidrogênio e Oxigênio, e fazemos sua pesagem respectivamente.
Assim, ao realizarmos esses passos, colocaríamos os valores obtidos na tabela para podermos entender a proporção.
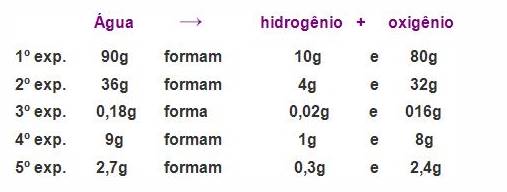
.
É interessante notar que tudo até agora estudado pode ser comprovado em um laboratório, com a utilização de uma balança.No seculo XIX, muitos quimicos não acreditavam na lei de Proust pois, em suas experiências, desconsideravam as impurezas existentes que não podiam ser separadas nem detectadas.
Assim, com essa Lei, os cientistas conseguiram a criação de uma fórmula química 'fixa' para cada composto químico. Graças a isso, hoje em dia, quando se fala "água", pensa-se em "H2O"
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Lei das proporções múltipla ou lei de Dalton
Como citar este documento: MASCAI, Fábio Augusto Amaral. Leis Ponderais. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/ home/materias/leis-ponderais.html. Acesso em: [data de acesso].
foi um grande estudioso da constituição da matéria, sendo mais conhecido por sua teoria Porém Dalton também contribuiu para as leis experimentais em que dizem respeitos às massas, com a Lei de proporções múltiplas ou Lei de DaltonPodemos entender como Lei de Dalton: A soma das pressões parciais dos gases componentes de uma mistura gasosa é igual à pressão total exercida pela mistura, desde que os gases não reajam entre si.
Assim, podemos escrever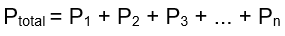
E associando com a equação de
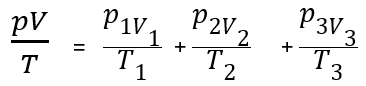
Logo, podemos discutir o motivo de quando viajamos para lugares de maior altitude, como a Bolívia, sentimos uma dificuldade para respirar, para se adaptar à pressão atmosférica?
Por que exatamente isso acontece? Basicamente porque a quantidade de moléculas de oxigênio disponíveis, literalmente, diminui. "A pressão atmosférica, que nada mais é do que o peso do ar sobre nós, diminui com o aumento da altitude, ou seja, quanto mais alto estamos, menor é a pressão do ar sobre a gente. Por sua vez, quanto menor é essa pressão, menor será também a pressão especificamente das moléculas de oxigênio, isto é, a quantidade de oxigênio sobre a gente", explica o fisiologista Thiago Lopes Ribeiro, do Centro Olímpico de Treinamento e Pesquisa da Universidade Federal de São Paulo (Unifesp).
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Exemplos
Como citar este documento: MASCAI, Fábio Augusto Amaral. Leis Ponderais. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/ home/materias/leis-ponderais.html. Acesso em: [data de acesso].
Exemplo 1
Sabe-se que o gás Hidrogênio reage com o gás Oxigênio na proporção 1:8, em massa, para formar água. Sabendo desse fato, determine os valores das massas X, Y e Z na tabela a seguir, respectivamente:
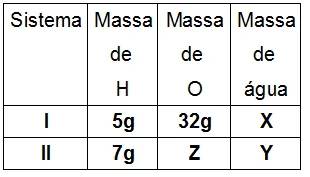
a) 36 g, 44 g e 51,8 g
b) 33,6 g, 2,4 g e 52 g
c) 32 g, 44 g e 51 g
d) 36 g, 48 g e 52 g
e) 37 g, 44,8 g e 51,8 g
5g + 32g = x
x = 37g
2º Passo: Encontrar massa de Z, por Proust.
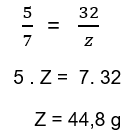
3º Passo: Encontrar Y por Lavoisier
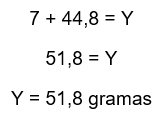
Resposta: e
Exemplo 2
Uma das alternativas para diminuir a quantidade de dióxido de carbono liberada para a atmosfera consiste em borbulhar esse gás em solução aquosa de hidróxido de sódio. A reação que ocorre pode ser representada da seguinte forma:
dióxido de carbono + hidróxido de sódio → carbonato de sódio + água
Sabendo que 44 g de dióxido de carbono reagem com o hidróxido de sódio, formando 106 g de carbonato de sódio e 18 g de água, qual é a massa de hidróxido de sódio necessária para que o gás carbônico seja totalmente consumido?
a) 20 g.
b) 62 g.
c) 80 g.
d) 106 g.
e) 112 g.
1º Passo: Armar equação e colocar os dados do enunciado
dióxido de carbono + hidróxido de sódio → carbonato de sódio + água
44 g x 106 g 18 g
2º Passo: Encontrar x, por Lavoisier.
44 + x = 106 + 18
x = 106 + 18 - 44
x = 80 g.
Exemplo 3
Em um recipiente de 10 l são misturados 3 l de oxigênio a 37º C, sob pressão de 4 atm, e 5 l de nitrogênio a 77º C, sob pressão de 2 atm. Determine a pressão total da mistura a 27 ºC.
1º Passo: organizar informações dadas pelo exercício
V = 10l, V1= 3l , T1=310K , p1= 4atm, V2= 5l , T2= 350 K , p2 = 2atm
Lembre de transformar a temperatura de oC para K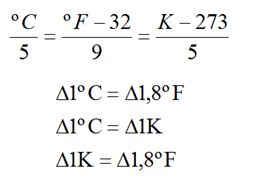
Figura 7: Conversão entre escalas
Fonte https://www.gestaoeducacional. com.br/escalas-termometricas-temperatura/
2 º Passo: substituir valores na equação p = 2atm
![]() =
= ![]() +
+ ![]() +
+ ![]()
![]() =
= ![]() +
+ ![]()
p = 2atm
Exercícios
4) Ao se passar uma corrente contínua na água (eletrólise), ela é decomposta em seus constituintes: hidrogênio e oxigênio. Os dados experimentais mostram que as massas dessas duas substâncias sempre estarão na mesma proporção de 1:8, seguindo a Lei Ponderal de Proust. Essas reações também seguem a lei de Lavoisier, isto é, a massa no sistema permanece constante.
Com base nessas leis, indique a alternativa que traz os respectivos valores das massas (em gramas) que substituiriam corretamente as letras A, B, C e D nesses experimentos: a

a) 4,5/ 1,0/ 16,0/ 99,99.
b) 3,5/ 0,1/ 20,0/ 8,0.
c)5,0/ 17,0/ 28,0/ 8,8.
d) 6,0/2,0/ 16,0/ 8,0.
e) 4,5 1,0/ 20,0/8,8.
5) (UFAM) Um sistema composto pela mistura de três gases, A, B e C, está a uma temperatura de 27ºC e apresenta uma pressão de 4 atm. Considerando que o volume total do sistema seja 37 litros e que os gases A e B apresentam respectivamente pressões parciais 2 e 1 atm, a quantidade de matéria dos gases A, B, e C é, respectivamente:
Dado: R = 0,082 atm . L . mol-1 . K-1.
a)0,5 mol; 0,25 mol; 0,25 mol
b)3,0 mols; 2,0 mols; 1;0 mol
c)33 mols; 16 mols; 16 mols
d)3,0 mols; 1,5 mols; 1,5 mols
e)1,5 mols; 3,0 mols; 1,5 mols
6) (UFF 2009) Desde a Antiguidade, diversos povos obtiveram metais, vidro, tecidos, bebidas alcoólicas, sabões, perfumes, ligas metálicas, descobriram elementos e sintetizaram substâncias que passaram a ser usadas como medicamentos. No século XVIII, a Química, a exemplo da Física, torna-se uma ciência exata. Lavoisier iniciou na Química o método científico, estudando os porquês e as causas dos fenômenos. Assim, descobriu que as transformações químicas e físicas ocorrem com a conservação da matéria. Outras leis químicas também foram propostas e, dentre elas, as ponderais, ainda válidas. Com base nas leis ponderais, pode-se afirmar que, segundo:
I. a Lei da Conservação da Massa (Lavoisier), 1,0 g de Ferro ao ser oxidado pelo Oxigênio, produz 1,0 g de Óxido Férrico;
II. a Lei da Conservação da Massa, ao se usar 16,0 g de Oxigênio molecular para reagir completamente com 40,0 g de Cálcio, são produzidas 56g de Óxido de Cálcio;
III. a Lei das Proporções Definidas, se 1,0g de Ferro reage com 0,29 g de Oxigênio para formar o composto Óxido Ferroso, 2,0 g de Ferro reagirão com 0,87 g de Oxigênio, produzindo o mesmo composto;
IV. a Lei das Proporções Múltiplas, dois mols de Ferro reagem com dois mols de Oxigênio para formar Óxido Ferroso; logo, dois mols de Ferro reagirão com três mols de Oxigênio para formar Óxido Férrico.
Assinale a opção correta.
a) As afirmativas I e II estão corretas.
b) A afirmativa II está correta.
c) As afirmativas II e III estão corretas.
d) As afirmativas II e IV estão corretas.
7) (Mack-SP) Uma mistura de 1,5 mol de gás carbônico, 8 g de metano (16 g/mol) e 44,8 L de monóxido de carbono está contida em um balão de 30 L nas CNTP. É correto dizer que Dado: volume molar nas CNTP = 22,4 L/mol.
a) a pressão parcial do monóxido de carbono é o dobro da do metano.
b) a pressão parcial do metano é o triplo da do gás carbônico.
c) a pressão do gás carbônico é 1/4 da do monóxido de carbono.
d) a pressão parcial do monóxido de carbono é o quádruplo da do metano.
e) a pressão total é igual a 4 atm.
8) (Uni-Facef-SP) Foram realizados dois experimentos cujos dados constam na tabela.
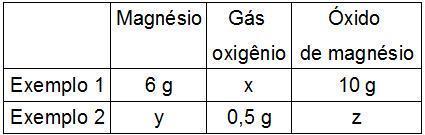
Os valores de x, y e z, em gramas, que completam, correta e respectivamente, a tabela são:
a) 4,0; 12,0 e 12,5.
b) 16,0; 6,0 e 5,5.
c) 4,0; 0,75 e 1,25.
d) 16,0; 0,75 e 0,25.
e) 4,0; 1,5 e 2,0.
9) (UEL-PR) Verifica-se, experimentalmente, que 2,0 g de hidrogênio reagem completamente com 0,50 mol de oxigênio para formar água. Repetindo a experiência com 24 x 1023 moléculas de hidrogênio, quantos mols de oxigênio serão necessários? d
a) 0,50 b) 1,0 c) 1,5 d) 2,0 e) 4,0
10) A reação entre 40 g de álcool propílico e 96 g de oxigênio produziu 48 g de água e gás carbônico. A massa de gás carbônico obtida foi de?
C3H8O + 9/2 O2![]() 3 CO2 + 4 H2O
3 CO2 + 4 H2O
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Exercícios
Como citar este documento: MASCAI, Fábio Augusto Amaral. Leis Ponderais. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/ home/materias/leis-ponderais.html. Acesso em: [data de acesso].
1)Ao se passar uma corrente contínua na água (eletrólise), ela é decomposta em seus constituintes: hidrogênio e oxigênio. Os dados experimentais mostram que as massas dessas duas substâncias sempre estarão na mesma proporção de 1:8, seguindo a Lei Ponderal de Proust. Essas reações também seguem a lei de Lavoisier, isto é, a massa no sistema permanece constante.
Com base nessas leis, indique a alternativa que traz os respectivos valores das massas (em gramas) que substituiriam corretamente as letras A, B, C e D nesses experimentos:

a) 4,5/ 1,0/ 16,0/ 99,99.
b) 3,5/ 0,1/ 20,0/ 8,0.
c)5,0/ 17,0/ 28,0/ 8,8.
d) 6,0/2,0/ 16,0/ 8,0.
e) 4,5 1,0/ 20,0/8,8.
2)Em um recipiente de 10 l são misturados 3 l de oxigênio a 37º C, sob pressão de 4 atm, e 5 l de nitrogênio a 77º C, sob pressão de 2 atm. Determine a pressão total da mistura a 27 ºC.
2 atm, Através dos dados do enunciado e a equação ![]() =
= ![]() +
+ ![]() +
+ ![]() , conseguimos encontrar que p = 2 atm
, conseguimos encontrar que p = 2 atm
3) Uma das alternativas para diminuir a quantidade de dióxido de carbono liberada para a atmosfera consiste em borbulhar esse gás em solução aquosa de hidróxido de sódio. A reação que ocorre pode ser representada da seguinte forma:
dióxido de carbono + hidróxido de sódio → carbonato de sódio + água
Sabendo que 44 g de dióxido de carbono reagem com o hidróxido de sódio, formando 106 g de carbonato de sódio e 18 g de água, qual é a massa de hidróxido de sódio necessária para que o gás carbônico seja totalmente consumido?
a) 20 g.
b) 62 g.
c) 80 g.
d) 106 g.
e) 112 g.
Resposta : C, Conseguimos encontrar a massa de hidróxido de sódio através das informações do enunciado e utilizando Lavoisier.
4) Sabe-se que o gás Hidrogênio reage com o gás Oxigênio na proporção 1:8, em massa, para formar água. Sabendo desse fato, determine os valores das massas X, Y e Z na tabela a seguir, respectivamente:
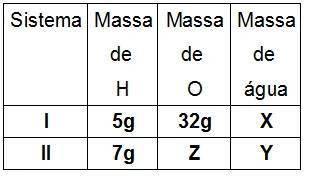
a) 36 g, 44 g e 51,8 g
b) 33,6 g, 2,4 g e 52 g
c) 32 g, 44 g e 51 g
d) 36 g, 48 g e 52 g
e) 37 g, 44,8 g e 51,8 g
E. Conseguimos encontrar X e Y por lavoisier, e Z por Dalton
5) (Mack-SP) Uma mistura de 1,5 mol de gás carbônico, 8 g de metano (16 g/mol) e 44,8 L de monóxido de carbono está contida em um balão de 30 L nas CNTP. É correto dizer que Dado: volume molar nas CNTP = 22,4 L/mol.
a) a pressão parcial do monóxido de carbono é o dobro da do metano.
b) a pressão parcial do metano é o triplo da do gás carbônico.
c) a pressão do gás carbônico é 1/4 da do monóxido de carbono.
d) a pressão parcial do monóxido de carbono é o quádruplo da do metano.
e) a pressão total é igual a 4 atm.
6) (UEL-PR) Verifica-se, experimentalmente, que 2,0 g de hidrogênio reagem completamente com 0,50 mol de oxigênio para formar água. Repetindo a experiência com 24 x 1023 moléculas de hidrogênio, quantos mols de oxigênio serão necessários?
7) (UFF 2009) Desde a Antiguidade, diversos povos obtiveram metais, vidro, tecidos, bebidas alcoólicas, sabões, perfumes, ligas metálicas, descobriram elementos e sintetizaram substâncias que passaram a ser usadas como medicamentos. No século XVIII, a Química, a exemplo da Física, torna-se uma ciência exata. Lavoisier iniciou na Química o método científico, estudando os porquês e as causas dos fenômenos. Assim, descobriu que as transformações químicas e físicas ocorrem com a conservação da matéria. Outras leis químicas também foram propostas e, dentre elas, as ponderais, ainda válidas. Com base nas leis ponderais, pode-se afirmar que, segundo:
I. a Lei da Conservação da Massa (Lavoisier), 1,0 g de Ferro ao ser oxidado pelo Oxigênio, produz 1,0 g de Óxido Férrico;
II. a Lei da Conservação da Massa, ao se usar 16,0 g de Oxigênio molecular para reagir completamente com 40,0 g de Cálcio, são produzidas 56g de Óxido de Cálcio;
III. a Lei das Proporções Definidas, se 1,0g de Ferro reage com 0,29 g de Oxigênio para formar o composto Óxido Ferroso, 2,0 g de Ferro reagirão com 0,87 g de Oxigênio, produzindo o mesmo composto;
IV. a Lei das Proporções Múltiplas, dois mols de Ferro reagem com dois mols de Oxigênio para formar Óxido Ferroso; logo, dois mols de Ferro reagirão com três mols de Oxigênio para formar Óxido Férrico.
Assinale a opção correta.
a) As afirmativas I e II estão corretas.
b) A afirmativa II está correta.
c) As afirmativas II e III estão corretas.
d) As afirmativas II e IV estão corretas.
Resposta : D. I - Falso, como a própria lei diz, são proporções definidas - o dobro da massa de ferro irá reagir com o dobro da massa de oxigênio, o que não está ocorrendo no enunciado. II - Verdadeira, nessa questão sim há uma conservação das massas, uma vez que a quantidade de massa utilizada nos produtos é formada nos reagentes. III - Falso, como a própria lei diz, são proporções definidas - o dobro da massa de ferro irá reagir com o dobro da massa de oxigênio, o que não está ocorrendo no enunciado. IV- Verdadeira, o enunciado segue as proporções definidas para se formarem os óxidos tanto férrico, de maior número de oxidação, quanto o ferroso, de menor número de oxidação.
8) A reação entre 40 g de álcool propílico e 96 g de oxigênio produziu 48 g de água e gás carbônico. A massa de gás carbônico obtida foi de?
![]()
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021



