Estudo dos Gases
IFSP - Cursinho Popular
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Gases e Atmosfera. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/estudo-gases.html. Acesso em: [data de acesso].
Introdução
Tópicos: Contextualização; Destrinchando conceitos importantes; Transformações Gasosas; Transformação Isotérmica; Transformação Isovolumétrica (isométrica/isocórica); Transformação Isobárica; Equação geral dos gases; O estado de um gás, Equação de Clapeyron; Pressão Parcial; Questões.
Os gases, predominantemente encontrados em nossa atmosfera, são as substâncias mais abundantes achadas na natureza. Substâncias nesse estado físico da matéria possuem propriedades muito características que dependem de certas variáveis. O conhecimento sobre esse comportamento dos gases e suas relações com a sociedade moderna vem se demonstrando essenciais para o desenvolvimento da humanidade.Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Vamos Relembrar - Estados da matéria
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Gases e Atmosfera. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/estudo-gases.html. Acesso em: [data de acesso].
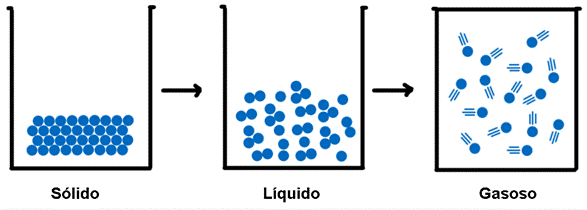
A matéria pode ser, fundamentalmente, dividida em três estados físicos que estão relacionados com a movimentação e proximidade das moléculas que compõem as substâncias. Os estados da matéria são: Sólido, Líquido e Gasoso. Figura 1 - Estados físicos da matéria |
Contextualização
A matéria no estado gasoso possui comportamentos que diferem muito dos observados nos líquidos ou sólidos. Por exemplo, devido ao grande espaçamento entre as suas moléculas, gases podem sofrer compressão ou expansão, alterando o volume que ocupam. Essa característica não é observada em líquidos ou sólidos, que possuem volume fixo.
Ao longo da história, alguns cientistas foram responsáveis por descrever certos comportamentos dos gases relacionados quanto a sua temperatura, pressão e volume, e como estas variáveis influenciam umas às outras.
A compreensão da performance dos gases foi fundamental para o desenvolvimento científico do século XIX. Os estudos da transformação do calor em trabalho em sistemas gasosos configurou a termodinâmica clássica, o que possibilitou o desenvolvimento de máquinas térmicas com rendimentos maximizados.
Destrinchando conceitos importantes
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Transformações Gasosas
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Gases e Atmosfera. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/estudo-gases.html. Acesso em: [data de acesso].
Como o estado de um gás depende diretamente de suas variáveis de estado (temperatura, volume e pressão), a alteração de uma ou mais delas faz com que o gás mude de estado. As transformações gasosas, portanto, ocorrem quando há uma mudança nas variáveis de estado de um sistema gasoso. Existem três principais tipos de transformações gasosas: A isotérmica, a isobárica e a isovolumétrica;
Transformação Isotérmica
A transformação isotérmica, como o próprio nome indica, ocorre quando não há variação na temperatura do gás, ou seja, as únicas variáveis serão a pressão e o volume. Nesta transformação, portanto, dizemos que a temperatura é constante.
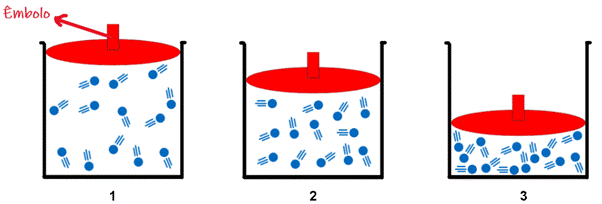
Para entendermos melhor como a pressão e o volume de um gás estão relacionados, vamos supor a seguinte situação: Imagine um recipiente cheio de algum gás qualquer, e que na parte superior deste recipiente encontra-se um êmbolo, dispositivo que pode deslizar para cima e para baixo modificando o volume ocupado pelo gás, como indica a figura 2.
Figura 2 - Representação esquemática da transformação isotérmica
Fonte: Guia do Estudante (adaptado). 1
Ao analisarmos a imagem 3 (onde o volume ocupado pelo gás é menor), é possível concluir que com menos espaço, as moléculas irão se chocar mais com as paredes do recipiente, causando o aumento da pressão. O contrário, caso o êmbolo subisse aumentando o volume do recipiente, com mais espaço para a movimentação das partículas, o número de choques entre as moléculas e as paredes do recipiente diminuiria, causando a diminuição da pressão (imagens 2 e 1).
Portanto, nota-se uma relação inversamente proporcional entre as variáveis Volume e Pressão, pois, quando a temperatura é constante, o aumento do volume ocupado pelo gás acarreta uma diminuição de sua pressão e a diminuição do volume ocupado pelo gás acarreta um aumento de sua pressão.
A seguir está representada a lei de Boyle , que relaciona algebricamente a relação inversamente proporcional entre Volume e Pressão de um gás a temperatura constante.
![]()
Onde:
P1 = Pressão inicial
V1 = Volume inicial
P2 = Pressão final
V2 = Volume final
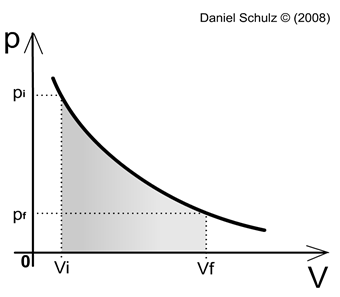
O gráfico a seguir, que representa pressão (p) por volume (V), descreve a curva formada em uma transformação isotérmica, onde é possível notar a relação de proporcionalidade inversa. Essa curva formada no gráfico por uma transformação isotérmica é comumente chamada de "isoterma".
Figura 3 - Gráfico Pressão x Volume de uma transformação isotérmica
Fonte: Instituto de Física da UFRGS 2
É possível notar que, ao passo que aumentamos uma das duas variáveis da transformação isotérmica a outra é proporcionalmente reduzida. Como a equação descrita pela Lei de Boyle envolve a igualdade entre o produto da pressão e volume iniciais e o produto da pressão e volume finais, podemos concluir que tais produtos darão origem a uma constante, que chamaremos de K. |
A transformação isovolumétrica é aquela na qual não ocorre variação do volume do gás, ou seja, as únicas variáveis serão pressão e temperatura. Nessa transformação, portanto, dizemos que o volume é constante.
Suponhamos um recipiente de volume fixo no qual se encontra um gás qualquer; o aumento da temperatura ocasiona o aumento da energia das moléculas do gás, resultando no aumento da velocidade das mesmas o que, por sua vez, acarreta no maior número de choques entre as moléculas e as paredes do recipiente aumentando assim a pressão exercida pelo gás.
Figura 4. Representação da transformação isométrica
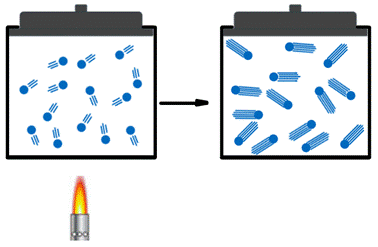
Fonte: Guia do Estudante (adaptado). 3
Quando há a diminuição da temperatura, as moléculas tornam-se mais lentas o que acaba por ocasionar na diminuição da pressão.
É possível notar, portanto, que temperatura e pressão possuem uma relação diretamente proporcional pois, quando o volume do gás permanece constante. O aumento da temperatura do gás ocasiona no aumento da pressão que o mesmo exerce, bem como a diminuição da temperatura do gás ocasiona na diminuição da pressão que ele exerce. Também é possível notar essa relação graficamente entre a proporcionalidade das variáveis pressão e temperatura na figura 5.
A seguir está representada a Lei de Charles , que relaciona algebricamente a relação diretamente proporcional entre temperatura e pressão de um gás quando o volume é constante.
![]()
Onde:
P1 = Pressão inicial
T1 = Temperatura inicial
P2 = Pressão final
T2 = Temperatura final
O gráfico a seguir, que representa pressão (P) por temperatura (T), descreve a reta formada em uma transformação isovolumétrica, onde é possível notar a relação diretamente proporcional entre a pressão e a temperatura de um gás em um sistema de volume constante.
Figura 5. Gráfico Pressão x Temperatura de uma transformação isovolumétrica
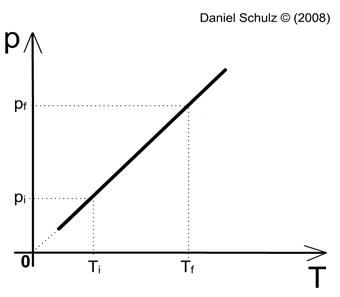
Fonte: Instituto de Física da UFRGS 4
É possível notar que, ao passo que aumentamos uma das duas variáveis da transformação isovolumétrica a outra é aumentada de forma proporcional . Como a equação descrita pela Lei de Charles envolve a igualdade entre a razão da Pressão inicial pela Temperatura inicial e a razão da Pressão final pela Temperatura final, podemos concluir que essas divisões resultarão na constante K. |
Transformação Isobárica
A transformação isobárica é aquela na qual não ocorre variação da pressão exercida pelo gás, ou seja, as únicas variáveis serão volume e temperatura. Nessa transformação, portanto, dizemos que a pressão é constante.
Suponhamos um recipiente onde se encontra um gás qualquer e que, neste mesmo recipiente, exista um êmbolo capaz de deslizar para cima e para baixo, sem qualquer tipo de resistência, modificando o volume ocupado pelo gás. Como vimos anteriormente, o aumento da temperatura acarreta um maior número de choques entre as moléculas e as paredes do recipiente; no entanto, como o recipiente pode mudar seu volume livremente sem qualquer tipo de resistência, o que ocorre nesta situação é o deslocamento do êmbolo para cima, isto é, um aumento do volume.
Figura 6. Representação da transformação isobárica
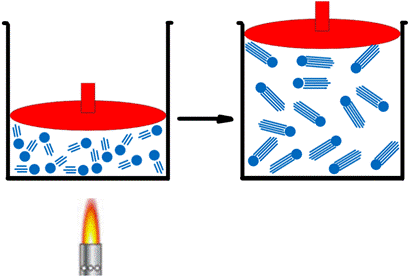
Fonte: Guia do Estudante (adaptado). 5
Quando há a diminuição da temperatura, as moléculas tornam-se mais lentas o que acaba por ocasionar o deslocamento do êmbolo para baixo, diminuindo assim o volume do recipiente.
É possível notar, portanto, que temperatura e volume possuem uma relação diretamente proporcional pois, quando a pressão do gás permanece constante, o aumento da temperatura do gás ocasiona o aumento de seu volume, bem como a diminuição da temperatura do gás ocasiona a diminuição do seu volume. A figura 7 demonstra graficamente esta relação entre as variáveis volume e temperatura.
A seguir está representada a Lei de Gay-Lussac , que relaciona algebricamente a relação diretamente proporcional entre a temperatura e o volume de um gás quando a pressão se mantém constante.
![]()
Onde:
V1 = Volume inicial
T1 = Temperatura inicial
V2 = Volume final
O gráfico a seguir, que representa Volume (V) por Temperatura (T), descreve a reta formada em uma transformação isobárica, onde é possível notar a relação diretamente proporcional entre o volume e a temperatura de um gás em um sistema de pressão constante.
Figura 7. Gráfico Volume x Temperatura de um gás ideal qualquer
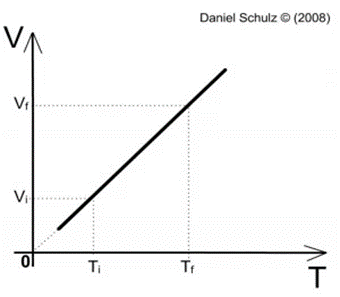
Fonte: Instituto de Física da UFRGS 6
É possível notar que, ao passo que aumentamos uma das duas variáveis da transformação isobárica a outra é aumentada de forma proporcional . Como a equação descrita pela Lei de Gay-Lussac envolve a igualdade entre a razão do volume inicial pela temperatura inicial e a razão do volume final pela temperatura final, podemos concluir que essas divisões resultarão na constante K. |
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Equação geral dos gases
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Gases e Atmosfera. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/estudo-gases.html. Acesso em: [data de acesso].
A equação ou lei geral dos gases correlaciona não apenas duas variáveis gasosas como vimos anteriormente, mas estabelece uma relação entre todas as três variáveis. Portanto, pode ser considerada uma junção das três leis que vimos anteriormente.
![]()
Onde:
P1 = Pressão inicial
V1 = Volume inicial
T1 = Temperatura inicial
P2 = Pressão final
V2 = Volume final
T2 = Temperatura final
Uma dica A equação geral dos gases pode ser utilizada para qualquer que seja a transformação gasosa. Observe que, se uma das variáveis permanece constante durante a transformação, ela poderá ser simplificada dessa maneira: Quando a temperatura é constante (transformação isotérmica)
|
O estado de um gás, a Equação de Clapeyron
A equação de Clapeyron não está associada com alguma transformação gasosa, ela, na verdade, descreve o estado de um gás em um determinado instante.
A equação de Clapeyron observa que as razões propostas pelas três leis das transformações gasosas, e, consequentemente, da equação geral dos gases, resultam em uma constante.
![]()
![]()
![]()
A Equação de Clapeyron define esta constante K como sendo o número de mols das moléculas do gás multiplicado pela constante universal dos gases R, que vale 0,082 atm.L/mol.
P . V = n . R . T
Onde:
P = Pressão do gás;
V = Volume ocupado pelo gás;
n = quantidade de matéria do gás, expressa em mols;
R = Constante universal dos gases;
T = Temperatura do gás em Kelvin.
Pressão parcial
A Pressão parcial é a pressão exercida por um único gás em uma mistura gasosa, isto é, a parcela da Pressão total que um gás exerce quando em um conjunto de gases. Suponhamos um recipiente que contenha uma mistura gasosa, a Pressão parcial exercida pelo gás dessa mistura pode ser determinada a partir da seguinte expressão:
![]()
Onde:
PA = Pressão parcial exercida pelo gás A;
P = Pressão total;
xA = Fração molar do gás A (razão entre o número de mols de moléculas de A e número de mols total da mistura gasosa).
![]()
Por fim, em uma mistura gasosa a pressão total é igual a soma das pressões parciais dos gases que a compõem.
![]()
É isso aí! Finalizamos o capítulo sobre o Estudo dos Gases. E aí, pronto para resolvermos alguns exercícios? |
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Exercícios
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Gases e Atmosfera. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/estudo-gases.html. Acesso em: [data de acesso].
1- (Fuvest - 2014) A tabela abaixo apresenta informações sobre cinco gases contidos em recipientes separados e selados.
|
Recipiente |
Gás |
T (K) |
P (atm) |
V (L) |
|
1 |
O3 |
273 |
1 |
22,4 |
|
2 |
Ne |
273 |
2 |
22,4 |
|
3 |
He |
273 |
4 |
22,4 |
|
4 |
N2 |
273 |
1 |
22,4 |
|
5 |
Ar |
273 |
1 |
22,4 |
T = temperatura
P = pressão
V = volume
Qual recipiente contém a mesma quantidade de átomos que um recipiente selado de 22,4 L, contendo H2, mantido a 2 atm e 273 K?
a) 1
b) 2
c) 3
d) 4
e) 5
2 - (UFRGS - 2016) Assinale a alternativa que preenche corretamente as lacunas do enunciado abaixo, na ordem em que aparecem.
Segundo a Teoria Cinética dos Gases, um gás ideal é constituído de um número enorme de moléculas cujas dimensões são desprezíveis, comparadas às distâncias médias entre elas. As moléculas movem-se continuamente em todas as direções e só há interação quando elas colidem entre si. Nesse modelo de gás ideal, as colisões entre as moléculas são ........, e a energia cinética total das moléculas ........ .
a) elásticas - aumenta
b) elásticas - permanece constante
c) elástica - diminui
d) inelástica - aumenta
e) inelástica - diminui
3 - (UFF - 2009) Uma amostra de um gás ideal sofre a seqüência de processos descrita pelo gráfico pressão versus temperatura mostrado.
.png)
É correto afirmar que o volume do gás:
a) diminui no trecho AB, permanece constante no trecho BC, aumenta no trecho CD;
b) aumenta no trecho AB, permanece constante no trecho BC, diminui no trecho CD;
c) aumenta no trecho AB, diminui no trecho BC, permanece constante no trecho CD;
d) permanece constante no trecho AB, aumenta no trecho BC, diminui no trecho CD;
e) permanece constante no trecho AB, aumenta no trecho BC, permanece constante no trecho CD.
4 - (PUC-RIO - 2008 - adaptada) Um mol de gás ideal, à pressão de 16,6 atm, ocupa uma caixa cúbica cujo volume é de 0,001 m³. Qual a temperatura em que este gás se encontra? (Considere 1,0 atm = 1,0x105 Pa, R = 8,3 J/mol K)
a) 100 K
b) 166 K
c) 200 K
d) 273 K
e) 303 K
5 - (Unespar - 2015) Considere as seguintes proposições referentes ao estudo dos gases:
I) Em um gás ideal, o movimento das moléculas é desordenado.
II) Em um gás ideal as moléculas interagem entre si apenas durante as eventuais colisões.
III) Numa transformação isotérmica a temperatura permanece constante enquanto a pressão varia em função do volume.
IV) Numa transformação isobárica a pressão varia em função do volume e a temperatura permanece constante.
Estão corretas:
a) I, II e IV
b) II, III e IV
c) I, II e III
d) I, III e IV
e) Todas as afirmações estão corretas
6 - (Mackenzie) Certa massa gasosa ocupa um volume de 112 cm³ a 1 atm de pressão e temperatura de 77ºC. O volume ocupado pela mesma massa gasosa a 27ºC de temperatura e 5 atm de pressão será igual a:
a) 19,20 litros
b) 1,92 centímetros cúbicos
c) 9,60 litros
d) 19,20 centímetros cúbicos
e) 9,60 centímetros cúbicos
7 - (PUC-SP) Um cilindro de 8,2L de capacidade contém 320g de gás oxigênio a 27°C. Um estudante abre a válvula do cilindro deixando escapar o gás até que a pressão seja reduzida para 7,5atm. Supondo-se que a temperatura permaneça constante, a pressão inicial no cilindro e a massa de gás liberada serão, respectivamente:
a) 30 atm e 240 g.
b) 30 atm e 160 g.
c) 63 atm e 280 g.
d) 2,7 atm e 20 g.
e) 63 atm e 140 g.
8 - (VUNESP) Enquanto descansa, o corpo de uma pessoa consome 200 mL de oxigênio por hora, a 25ºC e 1 atm, por kg de massa do corpo. Quantos mols de O2 são consumidos por uma pessoa que pesa 70 kg, em uma hora de descanso?
Dado: R = 0,082 L.atm/mol.K
a) 8,14 x 10–3
b) 6,83
c) 0,57
d) 0,10
e) 0,70
9- (Unitau) Se numa transformação isobárica, uma massa gasosa tiver seu volume aumentado de 3/4, a temperatura:
a) permanecerá constante.
b) aumentará na proporção de 7/4.
c) diminuirá na proporção de 7/4.
d) duplicará seu valor.
e) triplicará seu valor.
10 - (Cftce - 2004) Quanto aos gases, é correto afirmar que:
a) a 1 atm, 760 mmHg e 273 K, o volume do gás depende da sua posição na tabela periódica
b) duplicando-se a pressão de um gás e a temperatura, o volume fica naturalmente duplicado
c) associando-se as equações correspondentes às leis de Boyle, Charles e Gay-Lussac, é possível obter a equação Pi.Vi.Tf = Pf.Vf.Ti
d) a equação PV = nRT só é válida para gases ideais nas CNTP
e) na lei de Boyle, temos volume diretamente proporcional à pressão
Bibliografia Consultada
MOZETO, Antonio. Química Atmosférica: a química sobre nossas cabeças. Cadernos Temáticos de Química Nova na Escola, São Paulo, n. 1, p. 41-49, maio 2001. 7. Acesso em: 28 jan. 2021.
SCHULZ, Daniel. Transformação isotérmica, Instituto de Física, Porto Alegre, 2009. 8
SCHULZ, Daniel. Transformação isocórica, Instituto de Física, Porto Alegre, 2009. 9
SCHULZ, Daniel. Transformação isobárica, Instituto de Física, Porto Alegre, 2009. 10
TERMOLOGIA: Transformações gasosas. Guia do Estudante, c2021. 11
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021