
Equilíbrio químico
IFSP - Cursinho Popular
Como citar este documento: MONTEIRO, Wallasse G. Romão. Equilíbrio químico. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/equilibrio-quimico.html. Acesso em: [data de acesso].
Introdução
Tópicos: Introdução; Constante de equilíbrio Kc; Constante de equilíbrio e pressões parciais Kp; Grau de equilíbrio; Fatores que afetam o estado de equilíbrio; Exercícios.
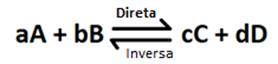
Equilíbrio químico é o nome dado ao ramo da físico-química que estuda qualquer reação química que seja
, que pode ser no sentido direto ou inverso. Consiste em um processo dinâmico em que a quantidade de reagentes e produtos permanecem constantes, uma vez que os processos diretos e inversos ocorrem com a mesma rapidez.
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Equilíbrio
Como citar este documento: MONTEIRO, Wallasse G. Romão. Equilíbrio químico. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/equilibrio-quimico.html. Acesso em: [data de acesso].
O seu estudo é relevante para compreender o comportamento dos reagentes e produtos de uma reação, mas também são importantes para que o equilíbrio possa ser mantido, melhorando a obtenção de certas substâncias.
A velocidade de reação no sentido direto e no sentido inverso são iguais ao atingir o ponto de equilíbrio.
Vdireta = Vinversa
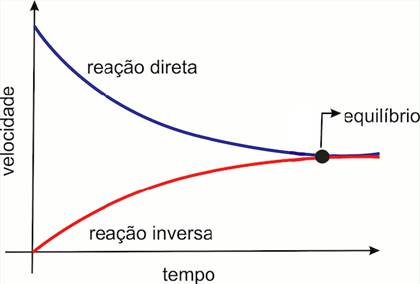
No gráfico da figura 1, temos um sistema que, inicialmente, apresenta somente os reagentes A e B. No início da reação é possível observar uma velocidade maior na formação dos produtos C e D (curva em vermelho), e essa velocidade decresce - em função da diminuição da concentração dos reagentes - até chegar em um ponto de equilíbrio, em que a velocidade da reação direta (da esquerda para a direita) se iguala à velocidade da reação inversa (da direita para a esquerda).
Figura 1 - Velocidade de reação direta e inversa em função do tempo
Fonte: Wikicommons (20--?) apud Globo.com (20--?) (http://educacao.globo.com/quimica/assunto/equilibrio-quimico/equilibrio-quimico-e-constante-de-equilibrio.html)
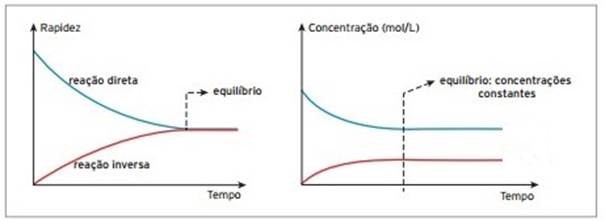
Na figura 2, podemos observar a variação na concentração de produtos e reagentes até se atingir o ponto de equilíbrio, representado pela linha tracejada. Note que após atingir esse ponto, a concentração dos produtos e reagentes ficam constantes. Dependendo da reação, esse gráfico pode ter esses tipos de comportamentos em A e B, um em que a concentração de produtos supera a concentração de reagentes e um em que a concentração de reagentes se mantém maior que a de produtos, até atingir o ponto de equilíbrio.
Figura 2 - Variação na concentração de produtos e reagentes em função do tempo
Fonte: Descomplica, 2017 (adaptado) (https://descomplica.com.br/artigo/o-que-e-equilibrio-quimico/4Qb/)
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Constante de equilíbrio KC
Como citar este documento: MONTEIRO, Wallasse G. Romão. Equilíbrio químico. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/equilibrio-quimico.html. Acesso em: [data de acesso].
A constante de equilíbrio, representada por Kc, são determinadas a partir de dados experimentais. Ela é calculada a partir da razão entre a quantidade de produtos e a quantidade de reagentes.
![]()
Dos estudos sobre a lei das ações das massas, através da lei da velocidade, podemos descrever a cinética das reações químicas. Para este exemplo, teríamos:
![]()
![]()
Sendo ![]() a velocidade da reação direta, e
a velocidade da reação direta, e ![]() a velocidade da reação inversa.
a velocidade da reação inversa.
Já discutimos anteriormente, que uma reação reversível atinge o equilíbrio quando as velocidades no sentido direto e inverso se igualam, ou seja, ![]() .
.
Assim, vamos igualar os dois termos:
![]()
![]()
![]() é o que chamamos de
é o que chamamos de ![]() .
.
Assim:
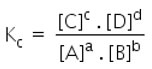
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Exemplos
Como citar este documento: MONTEIRO, Wallasse G. Romão. Equilíbrio químico. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/equilibrio-quimico.html. Acesso em: [data de acesso].
Considere a reação a seguir:
![]()
Suponhamos, que experimentalmente para essa reação, eu tenha obtido os seguintes resultados:

Determine a constante de equilíbrio, ![]() .
.
A relação entre a concentração de H2, I2 e HI é dada por ![]() , portanto podemos encontrar a constante de equilíbrio:
, portanto podemos encontrar a constante de equilíbrio:
![]()
Observem neste outro exemplo em que temos os produtos formados em estado sólido e líquido, respectivamente. Eles não serão levados em consideração nos cálculos, já que não interferem no estado de equilíbrio.
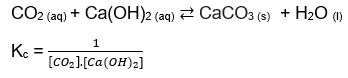
Para descobrir a constante de equilíbrio, basta substituirmos os valores em mol.L-1 que obtivermos experimentalmente.
Constante de equilíbrio e pressões parciais Kp
Para os gases - quando ao menos um dos componentes do equilíbrio estiver no estado gasoso, seja ele reagente ou produto - podemos escrever a equação de equilíbrio em termos de pressões parciais.
Exemplo 1.
![]()
Em termos de concentração, Kc, temos a seguinte expressão
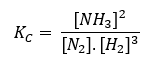
Em termos de pressão, Kp, temos a seguinte expressão:
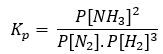
Ela é semelhante à constante de equilíbrio KC. A diferença é que usamos as pressões parciais ao invés da concentração em mol.L-1.
Exemplo 2.
(UFES) Numa determinada temperatura, as pressões parciais de cada componente da reação ![]() , no equilíbrio, valem:
, no equilíbrio, valem: ![]() Qual o valor de Kp?
Qual o valor de Kp?
(A) 1,6
(B) 2,65
(C) 0,8
(D) 0,0625
(E) 0,625
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Grau de equilíbrio
Como citar este documento: MONTEIRO, Wallasse G. Romão. Equilíbrio químico. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/equilibrio-quimico.html. Acesso em: [data de acesso].
O grau de equilíbrio, α, é a razão entre a quantidade de matéria consumida - até o estabelecimento do equilíbrio químico - e a quantidade de matéria inicial, em mol.

Exemplo 1.
No interior de um reator previamente evacuado, colocou-se 10 mols de SO3(g).
Após o estabelecimento do equilíbrio: ![]() observou-se que existiam 3,5 mols de SO3(g) em equilíbrio com SO2(g) e O2(g).
observou-se que existiam 3,5 mols de SO3(g) em equilíbrio com SO2(g) e O2(g).
Calcule o grau de equilíbrio (α) da reação.

Fatores que afetam o estado de equilíbrio
O estado de equilíbrio de uma reação pode sofrer modificações em função dos fatores de equilíbrio a que está submetido o sistema. Os fatores que provocam essa perturbação são a concentração dos participantes, a pressão e a temperatura.
O efeito provocado pela alteração de qualquer um dos fatores de equilíbrio é regido pelo Princípio de Le Chatelier, que estabelece:
"Quando se exerce uma ação num sistema em equilíbrio, este se desloca no sentido da reação que neutraliza essa ação".
Baseado neste princípio é possível prever os efeitos de ações impostas a um sistema em equilíbrio.
- Temperatura
Para demonstrarmos de que forma a temperatura desloca o equilíbrio em um sistema, consideremos a seguinte reação:
![]()
Primeiramente é importante observar que esta é uma reação exotérmica (∆H<0), ou seja, é uma reação que libera calor para o lado dos produtos (da esquerda para a direita). Como é uma reação reversível, essa reação será endotérmica (∆H>0), da direita para esquerda, consumindo calor.
Imaginemos que eu aumente a temperatura do sistema, o que acontecerá? Neste caso, a temperatura irá causar uma perturbação no equilíbrio, então o sistema deslocará a reação no sentido da reação que neutraliza essa ação. Uma forma de voltar ao equilíbrio é consumindo esse excesso de calor. Sabemos que o lado que consome o calor, é o lado endotérmico do sistema. Neste caso é o lado dos produtos, portanto dizemos que a reação se deslocou para a direita.
Vamos pensar na situação inversa. Se eu diminuir a temperatura do sistema, o que deve ocorrer para que o sistema volte ao equilíbrio? Neste caso, teremos que aumentar a temperatura do sistema para voltar como era antes, e o lado que gera calor é o lado exotérmico. Assim, dizemos que a reação se deslocou para a esquerda – lado dos reagentes.
A regra para a temperatura é:
- Se eu aumentar a temperatura, o equilíbrio se desloca para o sentido endotérmico.
Se eu diminuir a temperatura, o equilíbrio se desloca para o sentido exotérmico.
- Pressão
Para demonstrarmos de que forma a pressão desloca o equilíbrio em um sistema, consideremos a seguinte reação:
![]()
Diferentemente da temperatura, no caso da pressão não faz diferença a entalpia do sistema.
Primeiramente é importante observar os
de cada lado da reação. No lado dos reagentes temos 3 unidades de volume (1+2) e no lado dos produtos temos 2 unidades de volume.
A regra para a pressão é a seguinte:
- Quando aumentamos a pressão do sistema, a reação se desloca para o lado de menor volume;
- Quando diminuímos a pressão do sistema, a reação se desloca para o lado de maior volume.
No exemplo acima, concluímos que se aumentarmos a pressão do sistema a reação se deslocará para a esquerda – lado dos produtos. Caso contrário, se diminuímos a pressão, a reação se desloca para a direita – lado dos reagentes.
É importante destacar, que somente o volume das espécies gasosas são importantes. Além disso, caso ambos volumes sejam idênticos, a pressão não afeta o equilíbrio da reação.
- Concentração
Para demonstrarmos de que forma a concentração desloca o equilíbrio em um sistema, consideremos a mesma equação anterior:
![]()
Imaginemos que eu tenha minha reação equilibrada, e eu perturbe esse equilíbrio adicionando mais reagentes – pode ser mais N2 ou O2. Em que sentido minha reação irá se deslocar para neutralizar essa perturbação?
Se eu adicionar mais participantes, a reação passará a consumir esses participantes em excesso mais rapidamente para voltar ao equilíbrio, fazendo com que haja um maior aumento na concentração do lado oposto. Dessa forma, dizemos que a reação se desloca para o lado oposto
- Se eu aumentar a concentração de reagentes, a reação se desloca para a direita;
- Se eu aumentar a concentração de produtos, ocorre o oposto – a reação se desloca para a esquerda;
- Se eu diminuir a concentração de reagentes, a reação se desloca para a esquerda;
- Se eu diminuir a concentração de produtos, a reação se desloca para a direita.
Catalisadores
Catalisadores são substâncias usadas para acelerar a velocidade de reações químicas, sem que elas sejam consumidas durante o processo. De maneira geral, um catalisador aje na diminuição da energia de ativação da reação química. Os catalisadores não têm efeito sobre o equilíbrio das reações, ou seja, um catalisador pode acelerar ou retardar a velocidade na qual uma reação atinge o equilíbrio sem afetar a composição do seu equilíbrio, possibilitando que as moléculas de reagentes se convertam em produtos sem sofrer modificações.
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Teste seu entendimento sobre os princípios de Le Chatelier.
Como citar este documento: MONTEIRO, Wallasse G. Romão. Equilíbrio químico. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/equilibrio-quimico.html. Acesso em: [data de acesso].
1. A seguinte reação exotérmica acontece até atingir o equilíbrio.
![]()
O que acontece quando a temperatura diminui?
Escolha 1 resposta:
- A reação direta é favorecida
- A reação inversa é favorecida
- A reação de mantém em equilíbrio
2. A seguinte reação acontece até atingir o equilíbrio.
![]()
O que acontece quando mais NO(g) é adicionado?
Escolha 1 resposta:
- A reação direta é favorecida
- A reação inversa é favorecida
- A reação de mantém em equilíbrio
3. A seguinte reação acontece até atingir o equilíbrio.
![]()
O que acontece quando o gás inerte argônio, Ar (g), é adicionado?
Escolha 1 resposta:
- A reação direta é favorecida
- A reação inversa é favorecida
- A reação de mantém em equilíbrio
A seguinte reação acontece até atingir o equilíbrio.
![]()
O que acontece com a reação quando o volume do recipiente onde ela ocorre aumenta?
Escolha 1 resposta:
- A reação direta é favorecida
- A reação inversa é favorecida
- A reação de mantém em equilíbrio
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Exercícios
Como citar este documento: MONTEIRO, Wallasse G. Romão. Equilíbrio químico. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/equilibrio-quimico.html. Acesso em: [data de acesso].
1. (UFRGS) Uma reação química atinge o equilíbrio quando:
a) ocorre simultaneamente nos sentidos direto e inverso.
b) as velocidades das reações direta e inversa são iguais.
c) os reagentes são totalmente consumidos.
d) a temperatura do sistema é igual à do ambiente.
e) a razão entre as concentrações dos reagentes e produtos é unitária.
2. (UFPE - PE) A fixação do nitrogênio, fundamental na produção de adubos inorgânicos, pode ser conseguida através da reação exotérmica ![]() No processo em equilíbrio, é possível aumentar a produção de amônia:
No processo em equilíbrio, é possível aumentar a produção de amônia:
b) retirando hidrogênio do interior do recipiente.
c) introduzindo ar no recipiente.
d) introduzindo nitrogênio no recipiente. e) aumentando a temperatura.
3. (UFSM - RS) A chuva ácida tem grande impacto sobre o meio ambiente, afetando principalmente a biodiversidade do planeta. Um dos principais poluentes da chuva ácida é o ácido nítrico formado a partir do óxido nítrico (NO), que reage com o oxigênio do ar formando o NO2. A equação de formação do HNO3 é:
Em relação ao equilíbrio da equação, analise as afirmativas.
I – O aumento da temperatura leva a um aumento da concentração de HNO3.
II – O aumento da pressão sobre o sistema tem como efeito o aumento da concentração de HNO3
III - O aumento da concentração de NO2 leva a um aumento da concentração de HNO3.
Está(ão) correta(s):
a)Apenas I. b) Apenas II. c) Apenas III
d) Apenas I e II.
e) Apenas II e III.
4. (FGV-RJ) A produção de suínos gera uma quantidade muito grande e controlada de dejetos, que vem sendo empregada em bioconversores para geração de gás metano. O metano, por sua vez, pode ser utilizado para obtenção de gás H2. Em uma reação denominada reforma, o metano reage com vapor d'água na presença de um catalisador formando hidrogênio e dióxido de carbono de acordo com o equilíbrio:
O deslocamento do equilíbrio no sentido da formação do H2 é favorecido por:
I. Aumento da pressão.
II. Adição do catalisador.
III. Aumento da temperatura.
É correto apenas o que se afirma, em:
a) I.
b) I e II.
c) II
d) II e III.
e) III.
5. (ENEM - 2015) Hipoxia ou mal das alturas consiste na diminuição de oxigênio (O2) no sangue arterial do organismo. Por essa razão, muitos atletas apresentam mal-estar (dores de cabeça, tontura, falta de ar, etc.) ao praticarem atividade física em altitudes elevadas. Nessas condições, ocorrerá uma diminuição na concentração de hemoglobina oxigenada (HbO2) em equilíbrio no sangue, conforme a relação:
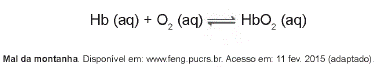
A alteração da concentração de hemoglobina oxigenada no sangue ocorre por causa do(a)
a) elevação da pressão arterial.
b) aumento da temperatura corporal.
c) redução da temperatura do ambiente.
d) queda da pressão parcial de oxigênio.
e) diminuição da quantidade de hemácias.
6. (ENEM - 2010) Às vezes, ao abrir um refrigerante, percebe-se que uma parte do produto vaza rapidamente pela extremidade do recipiente. A explicação para esse fato está relacionada à perturbação do equilíbrio químico existente entre alguns dos ingredientes do produto de acordo com a equação:
A alteração do equilíbrio anterior, relacionada ao vazamento do refrigerante nas condições descritas, tem como consequência a:
a) Liberação de CO2 para o ambiente.
b) Elevação da temperatura do recipiente.
c) Elevação da pressão interna do recipiente.
d) Elevação da concentração de CO2 no líquido.
e) Formação de uma quantidade significativa de H2O.
7. (PUC-PR) Consideremos o equilíbrio a 1000°C:
Devemos esperar um aumento na quantidade de monóxido de carbono quando:
a) a temperatura aumentar e a pressão aumentar.
b) a temperatura diminuir e a pressão diminuir.
c) a temperatura diminuir e a pressão aumentar.
d) a temperatura aumentar e a pressão diminuir.
e) somente com adição de catalisadores especiais
8. (PUC-PR) Considere o sistema em equilíbrio:
![]()
A melhor maneira de aumentar o rendimento de NH3 é:
a) aumentar a temperatura.
b) aumentar a pressão.
c) juntar um catalisador.
d) adicionar um gás inerte.
e) aumentar o volume do reator.
Referências
A CONSTANTE de equilíbrio K. Khan Academy, [s. l.], [20--?]. Disponível em: https://pt.khanacademy.org/science/chemistry/chemical-equilibrium/equilibrium-constant/a/the-equilibrium-constant-k . Acesso em: 08 mar. 2021.
CÁLCULO da constante de equilíbrio Kp usando as pressões parciais. Khan Academy, [s. l.], [20--?]. Disponível em: https://pt.khanacademy.org/science/chemistry/chemical-equilibrium/equilibrium-constant/a/calculating-equilibrium-constant-kp-using-partial-pressures . Acesso em: 08 mar. 2021.
DIAS, Diogo Lopes. Deslocamento do equilíbrio químico. Brasil Escola, [s. l.], [20--?]. Disponível em: https://brasilescola.uol.com.br/quimica/fatores-que-alteram-equilibrio-quimico.htm. Acesso em: 10 maio 2021.
LISBOA, Julio Cezar Foschini. Química: ensino médio 2º ano. São Paulo: Edições SM, 2012. p.114-203.
USANDO o princípio de Le chatelier. Khan Academy, [s. l.], [20--?]. Disponível em: https://pt.khanacademy.org/science/chemistry/chemical-equilibrium/factors-that-affect-chemical-equilibrium/e/using-le-chatelier-s-principle-exercise?modal=1. Acesso em: 09 mar. 2021.
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021