Distribuição eletrônica e Tabela Periódica
IFSP - Cursinho Popular
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Distribuição eletetrônica. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/distribuicao-eletronica.html. Acesso em: [data de acesso].
Introdução
Tópicos: contextualização da distribuição eletrônica; regras importantes; diagrama de energia; contextualização da tabela periódica; estrutura da tabela periódica atual; classificação dos elementos; grupos ou famílias; propriedades; questões.
Contextualização da distribuição eletrônica
A distribuição eletrônica refere–se à forma como os elétrons estão distribuídos entre os níveis ou camadas de energia. Em seu modelo atômico, Böhr dividiu a eletrosfera em sete camadas: K(n =1), L(n =2), M(n =3), N(n =4), O(n =5), P(n =6), Q(n =7). Além disso, de acordo com o modelo atômico moderno, sabemos que os elétrons estão localizados em subníveis (s, p, d, f), e cada 1 deles comporta um número máximo de elétrons: subnível s=2 e-; p=6 e-; d=10 e-; f=14 e-.Todos os direitos reservados. Proibida a reprodução total ou parcial sem indicação da fonte. Nenhuma parte do material disponível no site do Cursinho Popular IFSP Itapetininga pode ser reproduzida para fins comerciais. Copyright © Cursinho Popular IFSP Itapetininga 2021.
Regras importantes
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Distribuição eletetrônica. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/distribuicao-eletronica.html. Acesso em: [data de acesso].
Princípio da exclusão de Pauli
estabeleceu uma regra para a distribuição dos elétrons nos níveis, subníveis e orbitais. Esse princípio nos diz que os elétrons de um mesmo átomo não podem ter o mesmo número quântico. Número quântico é, de forma resumida, um conjunto de 4 algarismos que nos dá a localização do elétron na eletrosfera. O princípio também limita em 2, o número de elétrons que um orbital pode acomodar. Apesar de os elétrons serem partículas negativas, e tenderem a se repelir, esses elétrons conseguem dividir um mesmo orbital por possuírem diferentes.
Princípio da máxima multiplicidade
estabeleceu o princípio da máxima multiplicidade, também conhecida como Regra de Hund. Diz respeito à forma como os elétrons são preenchidos dentro de um subnível e dentro dos orbitais. Somente depois de cada orbital do subnível ter sido preenchido com um elétron, que eu poderemos acomodar o segundo elétron.
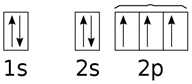
Ex: Vamos fazer a distribuição eletrônica (não se preocupe, veremos com mais detalhes como se faz a distribuição eletrônica mais adiante nesse capítulo!) do Neônio (Z=10). Suponhamos que eu esteja no subnível “p”. Este subnível possui 3 orbitais, e, portanto, comporta até 6 elétrons. O esquema a seguir mostra os orbitais (representados como quadrados e as setas representam os elétrons e o sentido da flecha representa seu spin), e como devemos fazer o preenchimento segundo a regra de Hund:
Primeiramente, acomodamos 1 elétron em cada orbital:
Depois preenchemos o restante, da esquerda para a direita:
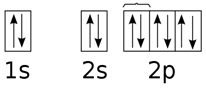
Diagrama de energia
O princípio de Aufbau estabeleceu as regras para a distribuição dos elétrons na eletrosfera. Segundo esta regra, os elétrons são distribuídos de forma crescente de energia, ou seja, a partir da primeira camada no subnível s. É muito importante seguir a ordem de distribuição conforme ilustrado na figura 1. A partir deste diagrama, podemos retirar informações muito úteis em relação ao átomo. Por exemplo: seu número de camadas, quantos elétrons ele apresenta na sua camada de valência (última camada preenchida com elétrons), saber sua classificação na tabela periódica, saber qual é o e saber o número de ligações que ele deve fazer para que possa ficar estável.
Figura 1 - Diagrama de Energia.

Fonte: Wikimedia Commons. 1
Para podermos fazer a distribuição eletrônica, precisamos saber o
do elemento químico . Essa informação é importante porque em um átomo neutro o número de prótons é igual ao número de elétrons. Assim, saberemos quantos elétrons devemos distribuir na eletrosfera.
Vejamos a distribuição eletrônica de alguns elementos químicos e como podemos retirar informações importantes a partir dela:
Todos os direitos reservados. Proibida a reprodução total ou parcial sem indicação da fonte. Nenhuma parte do material disponível no site do Cursinho Popular IFSP Itapetininga pode ser reproduzida para fins comerciais. Copyright © Cursinho Popular IFSP Itapetininga 2021.
Contextualização tabela periódica
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Distribuição eletetrônica. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/distribuicao-eletronica.html. Acesso em: [data de acesso].
A tabela periódica é, sem dúvidas, uma das maiores construções científicas da Humanidade. Sua importância é inestimável por prever as propriedades dos elementos químicos e dos compostos que vão se formar por meio de suas combinações. Essa previsibilidade é feita em função da forma com que os elementos estão agrupados na Tabela, que se dá não só pela ordem crescente de seus números atômicos, mas também em função de sua distribuição eletrônica. Tal organização apontou, de modo muito natural, a regularidade em uma série de propriedades químicas e físicas dos elementos. Como dito, a tabela periódica nos moldes como a conhecemos hoje foi uma construção da ciência, e como toda grande construção, ela demanda tempo e o trabalho de muitos autores. Veremos a seguir como essa construção se deu.
Em 1829, houve a primeira tentativa de agrupar os elementos químicos seguindo um critério lógico. O químico alemão
organizou os elementos em grupos de três, sendo que os elementos químicos de cada trio apresentavam características químicas semelhantes. Esse trio foi denominado de tríade. Seu modelo ficou conhecido como Tríades de Dobereiner. Porém, outros cientistas perceberam que as relações químicas se estendiam–se para além das tríades.
Em 1862, o geólogo e químico francês,
, apresentou uma maneira diferente de classificar os elementos químicos. Ele distribuiu os elementos em ordem crescente de massa atômica ao longo de uma faixa espiral de 45° existente em um cilindro. Após analisar essa organização, Chancourtois observou uma semelhança entre as propriedades químicas dos elementos posicionados na mesma linha. Porém, isso não funcionava para todos. Esse modelo é conhecido como Parafuso Telúrico, representado na figura 2 .
Figura 2 - Modelo do parafuso telúrico proposto por Chancourtois.
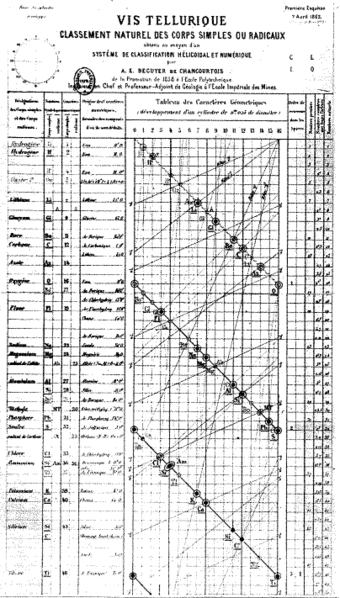
Fonte: Wikimedia Commons. 2
Em 1865, o químico inglês
organizou os elementos químicos e colocou-os em ordem crescente de suas massas atômicas em colunas verticais e observou que as propriedades dos elementos se repetiam periodicamente. Assim, ele propôs a lei das oitavas, em uma alusão a sua grande paixão: a música. Cada uma das colunas verticais possuía sete elementos. O grande problema era que seu modelo funcionava bem somente até o Cálcio, indicando que o modelo proposto deveria ser repensado.
Figura 3 - Modelo de organização de elementos proposto por Newlands.
Fonte: Wikimedia Commons. 3
Em 1869, o número de elementos químicos conhecidos era de 63. Os modelos apresentados até então possuíam um problema, pois muitos elementos com massas quase iguais eram colocados próximos sem uma semelhança que fizesse sentido. Foi então que , conhecido como pai da tabela periódica entrou em cena. Ele tinha anotado em fichas as propriedades dos elementos químicos conhecidos e acumulado um enorme acervo de informações. Certa vez, resolveu organizar essas fichas em ordem crescente de massa atômica. Após fazer isso, Mendeleev manteve o padrão, mas posicionou os elementos em colunas horizontais e verticais, respeitando as características e semelhanças dos elementos. Após fazer alguns rearranjos nessas fichas, ele percebeu uma periodicidade das propriedades em função do aumento da massa atômica dos elementos. Além disso, ele também deixou espaços em branco na tabela, reservados para elementos que ainda não haviam sido descobertos. Com isso, era possível prever as propriedades e características desses elementos desconhecidos. E aí nasceu a Tabela Periódica, de repetição de propriedades, em intervalos regulares, de elementos agrupados de acordo com características semelhantes. Ela está representada na figura 4.
Figura 4 - Forma de agrupar elementos proposta por Mendeleev.

Fonte: Wikimedia Commons. 4
O modelo de tabela periódica nos moldes como a conhecemos hoje, foi proposta no ano de 1913, pelo químico inglês
que a partir da tabela proposta por Mendeleev, que montou a Tabela Periódica na forma que a conhecemos hoje. A grande revolução feita por Moseley foi organizar os elementos em ordem crescente de número atômico (Z). Ele manteve a organização em colunas horizontais e verticais, porém posicionou os elementos de características químicas semelhantes nas mesmas colunas verticais. Posteriormente, a família dos gases nobres também fora adicionada à tabela periódica, após a descoberta dos elementos neônio, argônio, criptônio e xenônio.
Em 2016 houve a atualização mais recente da tabela periódica: os elementos 113, 114, 115, 117 e 118 passaram a fazer parte oficialmente dela.
Todos os direitos reservados. Proibida a reprodução total ou parcial sem indicação da fonte. Nenhuma parte do material disponível no site do Cursinho Popular IFSP Itapetininga pode ser reproduzida para fins comerciais. Copyright © Cursinho Popular IFSP Itapetininga 2021.
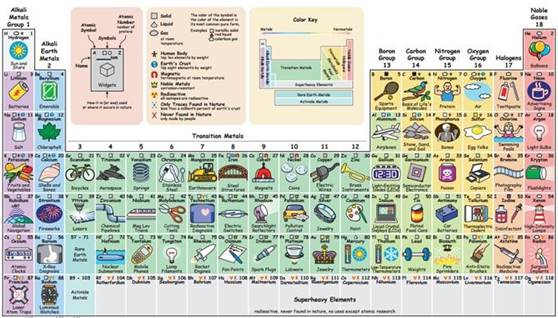
Estrutura da tabela periódica atual
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Distribuição eletetrônica. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/distribuicao-eletronica.html. Acesso em: [data de acesso].
A tabela periódica atual é construída em função do número atômico (Z) dos elementos, de forma crescente. E pode ser visualizada na figura 5.
Figura 5 - Tabela periódica atual.
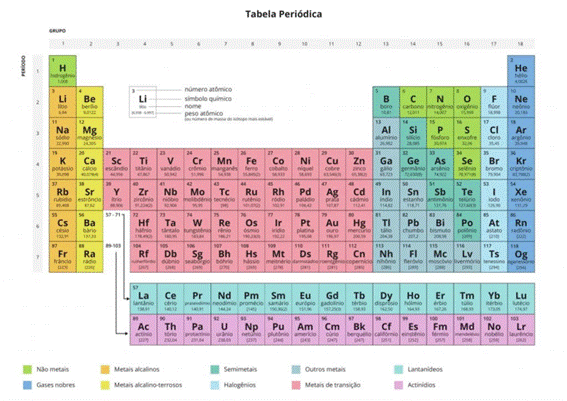
Fonte: Wikimedia Commons 5
18 famílias ou grupos (colunas verticais) - Os elementos de uma mesma família apresentam propriedades químicas semelhantes e propriedades físicas que variam gradualmente. Também apresentam o mesmo número de elétrons na camada de valência.
7 períodos (linhas horizontais) - Essas colunas indica o número n de níveis ou camadas que um determinado elemento tem preenchido com elétrons. Portanto, quanto maior o número do período do elemento, maior será a quantidade de níveis que cada um dos átomos do elemento apresenta. Os elementos que estão em uma mesma linha na tabela periódica apresentam propriedades químicas e físicas que variam.
Classificação dos Elementos
Metais
Constituem a maior parte dos elementos da tabela periódica. Eles apresentam algumas propriedades em comum, tais como:
- Apresentam boa condutividade térmica e elétrica;
- São sólidos à temperatura ambiente, com exceção do mercúrio;
- São dúcteis e maleáveis;
- Têm tendência a perder elétrons (formar cátions).
Ametais
Apresentam propriedades muito diferentes dos metais. Fazem parte deste grupo elementos como: Carbono, Nitrogênio, Oxigênio, Fósforo, Enxofre e Selênio, além dos elementos halógenos. Eles apresentam algumas propriedades em comum tais como:
- Em geral, não conduzem eletricidade ou calor;
- Apresentam-se no estado sólido, líquido ou gasoso;
- Baixo ponto de fusão e ebulição;
- Tem tendência a ganhar elétrons (formar ânions)
Semimetais
Apresentam um meio termo entre os metais e os ametais. Algumas das propriedades em comum entre os elementos deste grupo são:
- Elevado ponto de fusão;
- Condutividade térmica e elétrica moderada (semicondutores);
- Podem formar cátions ou ânions;
Hidrogênio
Apesar de estar posicionado no grupo 1, ele é considerado um elemento que não possui classificação.
Gases Nobres
São elementos que apresentam sua camada de valência completamente preenchida por elétrons, e fazem parte da família 18. Algumas das propriedades em comum desses elementos são:
- São considerados inertes (pouco reativos);
- Não precisam se ligar a nenhum elemento para ficarem estáveis.
- Alguns compósitos de gases nobres podem ser obtidos em laboratório, como os óxidos de Xenônio (XeO3 e XeO4), porém eles não são obtidos espontaneamente.
Grupos ou Famílias
Grupo 1
Esse é o grupo dos metais alcalinos. É composto por elementos que apresentam 1 elétron em sua camada de valência. São elementos que reagem facilmente com a água e oxigênio, formando óxidos e hidróxidos. Sua distribuição eletrônica termina em ns1, sendo n o número da camada de 1 até 7.
Sódio (Z=11) - 1s2 2s2 2p6 3s1
Grupo 2
Esse grupo é o grupo dos metais alcalinos terrosos. É composto por elementos que apresentam 2 elétrons em sua camada de valência. Apesar de não reagirem com água de forma tão rápida quanto os alcalinos, eles também costumam formar hidróxidos altamente básicos. Sua distribuição eletrônica termina em ns2, sendo n o número da camada de 1 a 7.
Berílio (Z=4) – 1s2 2s2
Grupos 3 – 12
Esses são os grupos dos metais de transição. É um grande grupo de elementos que apresentam características em comum. Sua distribuição eletrônica preenche totalmente os subníveis s e p, e possuem elétrons no subnível d, terminando em (n+1) s2nd1 até 10
Nb (Z = 41) – 1s2 2s2 2p6 3s2 3p6 4s2 3p10 4p6 5s2 4d3
Zn (Z = 30) - 1s2 2s2 2p6 3s2 3p6 4s2 3d10
Grupo 13
Esse é o grupo do Boro. Nesse grupo, todos os elementos apresentam 3 elétrons na camada de valência. Sua distribuição eletrônica termina em ns2 np1.
Boro (Z = 5) 1s2 2s2 2p1
Grupo 14
Esse é o grupo do Carbono. Nesse grupo, todos os elementos apresentam 4 elétrons na sua camada de valência. Sua distribuição eletrônica termina em ns2 np2.
Carbono (Z = 6) 1s2 2s2 2p2
Grupo 15
Esse é o grupo do Nitrogênio. Nesse grupo, todos os elementos apresentam 5 elétrons na camada de valência. Sua distribuição eletrônica termina em ns2 np3.
Nitrogênio (Z = 7) – 1s2 2s2 2p3
Grupo 16
Esse é o grupo dos calcogênios. Nesse grupo, todos os elementos apresentam 6 elétrons em sua camada de valência. Sua distribuição eletrônica termina em ns2 np4
Oxigênio (z = 8) – 1s2 2s2 2p4
Grupo 17
Esse é o grupo dos halogênios. Nesse grupo, todos os elementos apresentam 7 elétrons em sua camada de valência. Sua distribuição eletrônica termina em np10 (n+1)p5
Bromo (Z = 35) – 1s2 2s2 2p6 3s2 3p6 4s2 3p10 4p5
Grupo 18
Esse é o grupo dos gases nobres. Como já citado anteriormente, eles apresentam sua camada de valência totalmente preenchida por elétrons. Sua distribuição eletrônica termina em ns2 np6, com exceção do hélio que termina em ns2.
Hélio (Z = 2) – 1s2
Todos os direitos reservados. Proibida a reprodução total ou parcial sem indicação da fonte. Nenhuma parte do material disponível no site do Cursinho Popular IFSP Itapetininga pode ser reproduzida para fins comerciais. Copyright © Cursinho Popular IFSP Itapetininga 2021.
Propriedades
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Distribuição eletetrônica. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/distribuicao-eletronica.html. Acesso em: [data de acesso].
Na tabela periódica também podemos observar uma periodicidade nas principais propriedades químicas e físicas dos elementos. As propriedades químicas dos elementos são: energia de ionização, raio atômico, raio iônico, eletronegatividade, afinidade eletrônica e eletropositividade. As propriedades físicas são: pontos de fusão e ebulição, massa atômica, densidade atômica e volume atômico.
Raio atômico
Não é possível fazer precisamente a determinação do raio atômico (r) de um elemento isolado pois o mesmo não possui um limite determinado de sua eletrosfera.
O raio atômico pode ser entendido como a metade da distância (d) entre o núcleo de dois átomos vizinhos, considerando o átomo como se fosse esférico, como representado na figura 6.
Figura 6 - Representação do raio atômico.
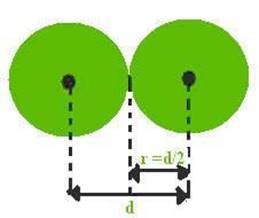
Fonte: Wikimedia Commons 6
Devemos considerar o átomo como um sistema elétrico, visto que ele possui cargas positivas e negativas.
A atração entre essas cargas tende a fazer o raio atômico diminuir, pois essas cargas se atrairão para ficarem o mais próximo possível. Assim, devemos considerar além do número de camadas, a carga nuclear efetiva (Zef) desse átomo em seu estado fundamental. A carga nuclear efetiva é a carga positiva sentida pelos elétrons que estão na camada de valência. Isso ocorre porque os elétrons que estão nas camadas mais interiores (S) acabam blindando a atração que o núcleo positivo exerce sobre os elétrons do último nível, protegendo esses elétrons do efeito máximo da atração do núcleo.
Zef = Z - S
Por exemplo:
3Li - 1s22s1
O lítio apresenta 2 camadas, sendo 1 elétron na camada n=2 (camada de valência) e 2 elétrons na camada 1 (camada interna); portanto, a carga sentida pelo elétron de valência será:
Zef = 3 – 2 = +1
Dessa forma, a periodicidade do raio atômico ocorre da seguinte forma:
- Em uma mesma família ou grupo, o raio atômico dos elementos tende a crescer de cima para baixo. Isso ocorre porque os elementos que estão mais abaixo, apresentam um número maior de colunas, consequentemente sua eletrosfera também será maior.
- Em um mesmo período ou camada, o raio atômico dos elementos tende a crescer da direita para a esquerda. Isso acontece, porque, apesar de possuírem o mesmo número de camadas, os elementos posicionados mais à direita da tabela possuem maior número de elétrons, e, portanto, uma carga nuclear efetiva maior. Isso faz com que a eletrosfera (negativa) tenha uma atração maior com o núcleo (positivo) fazendo com que os elétrons se aproximem mais do núcleo e o átomo fique menor.
Energia de ionização
A energia de ionização, também chamada de primeiro potencial de ionização, é a energia mínima necessária para "arrancar" um elétron de um átomo neutro em sua fase gasosa e formar um íon positivo (átomo com carga elétrica). Por exemplo:
Mg (g) + Energia → Mg+(g) + e-
A segunda energia de ionização é a energia que eu preciso fornecer ao átomo para “arrancar” o segundo elétron. A segunda energia de ionização é sempre maior que a primeira, a terceira energia de ionização é sempre maior que a segunda, e assim sucessivamente. Isso acontece, porque o íon fica cada vez mais positivo, atraindo cada vez mais seus elétrons.
12Mg (Z = 12) 1s2 2s2 2p6 3s2
Para o Magnésio, as energias de ionização obtidas experimentalmente em kg.mol-1 são:
1ª energia de ionização : +738 Mg (g) + Energia → Mg+(g) + 1e-
2ª energia de ionização :+1451 Mg (g) + Energia → Mg2+(g) + 2e-
3ª energia de ionização : +7733 Mg (g) + Energia → Mg3+(g) +3 e-
Observe que há um grande salto na energia necessária para remover o terceiro elétron comparado com o primeiro e o segundo. Na camada de valência, o Magnésio apresenta 2 elétrons. Assim veremos como fica a distribuição eletrônica ao removermos os 2 primeiros elétrons:
Ao removermos o 1º elétron - 1s2 2s2 2p6 3s1
Ao removermos o 2º elétron - 1s2 2s2 2p6
Ou seja, ao removermos o segundo elétron, não restará mais elétrons na camada n = 3. Por isso, o 3º elétron a ser removido estará na camada n = 2, mais próximo do núcleo e mais atraído por ele. Dessa forma, o Magnésio tem uma tendência a perder dois elétrons, pois a energia que teríamos que fornecer para remover o 3º elétron que se encontra em uma camada mais interna, é muito maior comparado aos dois primeiros elétrons da camada de valência.
A periodicidade da energia de ionização, ocorre da seguinte forma:
- Em uma mesma família ou grupo, ele tende a crescer de cima para baixo. Isso ocorre, porque os raios atômicos dos elementos posicionados na parte de cima são menores, isso faz com que seus elétrons externos estejam mais atraídos pelo núcleo, sendo mais difícil removê-los;
- Em um mesmo período ou camada, ela cresce da esquerda para direita. A explicação é a mesma. Isso ocorre porque os elementos posicionados mais à direita possuem raio atômico menor.
Raio iônico
Quando um átomo neutro recebe ou perde um elétron, ele se transforma no que chamamos de íon, e seu raio também sofre alteração.
- Se ele ganha elétrons – transforma – se em um íon chamado ânion;
- Se ele perde elétrons – transforma – se em íon chamado cátion.
Relação entre o raio do átomo em relação ao raio do cátion:
Por exemplo, vamos analisar o que acontece com o raio atômico quando removemos os elétrons de valência no átomo de Alumínio (Z = 13).
13Al (átomo neutro): 1s2 2s2 2p6 3s2 3p1
Elétrons internos (S) = 10
Número de prótons (Z) = 3
Carga nuclear efetiva (Zef) = 13 – 10 = 3
13Al3+(cátion de Alumínio): 1s2 2s2 2p6
Elétrons internos (S) = 2
Número de prótons (Z) = 13
Carga nuclear efetiva (Zef ) = 13 – 2 = 11
Assim, quando um átomo perde elétrons a carga nuclear efetiva sempre aumenta, consequentemente seu raio atômico diminui.
Raio átomo neutro > Raio Cátion |
Relação entre o raio do átomo em relação ao raio do ânion:
Por exemplo, vamos analisar o que acontece com o raio atômico quando adicionamos elétrons de valência no átomo de Oxigênio (Z = 8).
8O (átomo neutro): 1s2 2s2 2p4
Elétrons internos (S) = 2
Número de prótons (Z) = 8
Carga nuclear efetiva (Zef ) = 8 – 2 = 6
13 O 2-(ânion de Oxigênio): 1s2 2s2 2p6
Elétrons internos (S) = 2
Número de prótons (Z) = 8
Carga nuclear efetiva (Zef) = 8 – 2 = 6
Assim a carga nuclear efetiva não é alterada, porém a adição de elétrons na camada de valência faz com que haja uma expansão nesse nível. Isso ocorre porque no lugar onde havia apenas 6 elétrons, agora tem 8. Logo, a repulsão elétrica entre eles aumenta, fazendo com que se afastem e ocupando um espaço maior.
Raio átomo neutro < Raio Ânion |
Afinidade eletrônica
Eletroafinidade ou afinidade eletrônica corresponde à energia liberada quando um elétron é adicionado a um átomo neutro no estado gasoso. Ela mede o quanto um átomo “gosta” de um elétron.
X (g) + e- → X -(g) + Energia
Para compreendermos melhor essa ideia, vamos fazer a comparação entre dois átomos de um mesmo nível: Lítio e Flúor.
3Li (Z = 3) 1 s22s1
Elétrons internos (S) = 2
Número de prótons (Z) = 3
Carga nuclear efetiva (Zef ) = 3 – 2 = +1
9Fl (Z = 9) 1s2 2s2 2p5
Elétrons internos (S) = 2
Número de prótons (Z) = 9
Carga nuclear efetiva (Zef ) = 9 – 2 = +7
Olhando em termos de carga nuclear efetiva, observamos que a carga nuclear efetiva do Flúor é maior. Isso significa que é mais fácil de eu colocar um elétron no átomo de Flúor em relação ao Lítio, visto que sua atração é bem maior, ou seja, ele tem uma afinidade maior por elétrons. Na medida que eu percorro um grupo, existe uma maior atração dos elétrons com o núcleo quando há diminuição do raio atômico.
A periodicidade da afinidade eletrônica, ocorre da seguinte forma:
- Em uma mesma família ou grupo, ele tende a crescer de baixo para cima;
Todos os direitos reservados. Proibida a reprodução total ou parcial sem indicação da fonte. Nenhuma parte do material disponível no site do Cursinho Popular IFSP Itapetininga pode ser reproduzida para fins comerciais. Copyright © Cursinho Popular IFSP Itapetininga 2021.
Eletronegatividade
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Distribuição eletetrônica. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/distribuicao-eletronica.html. Acesso em: [data de acesso].
Eletronegatividade é a tendência que um átomo tem de atrair elétrons para perto de si, quando se encontra “ligado” a outro átomo de elemento químico diferente, numa substância composta.
Para exemplificar, vamos comparar dois elétrons da camada 3, o Cloro (Z = 17) e o Sódio (Z = 11)
11Na 1s22s22p63s1
17Cl17 1s2 2s2 2p63 2s2 3p5
O Sódio (Na) precisa de 7 elétrons para completar sua última camada e se tornar estável. Dessa forma, é mais fácil que o Sódio doe esse elétron e fique com a camada 2 completa e se torne estável.
O Cloro precisa de apenas 1 elétron para completar sua última camada e se tornar estável. Dessa forma, é mais fácil ele receber um elétron e completar a camada 3, do que ter que doar seus 7 elétrons de valência para ficar estável.
Agora vamos comparar 2 elementos de uma mesma família ou grupo, para descobrir qual é a periodicidade da eletronegatividade nas colunas.
3Li (Z = 3) 1s22s1
11Na (Z = 11) 1s22s22p63s1
Como vimos anteriormente, os elementos mais à esquerda tendem a doar elétrons. Olhando em termos de raio atômico, sabemos que o Sódio possui um raio atômico maior, consequentemente a atração exercida pelo núcleo em seu elétron de valência é menor comparado ao Lítio, e, portanto, é mais fácil ele doar esse elétron.
Dessa forma, a periodicidade da eletronegatividade ocorre da seguinte forma:
- Em uma mesma família ou grupo, ela tende a aumentar de baixo para cima;
- Em uma mesma camada, ela tende a aumentar da esquerda para a direita.
Eletropositividade
A eletropositividade indica a tendência que os átomos têm de se afastar de seus elétrons de valência quando fazem parte de uma ligação química com o átomo de um elemento químico diferente. A eletropositividade é o oposto da eletronegatividade.
Dessa a forma, a periodicidade da eletropositividade ocorre da seguinte forma:
- Em uma mesma família ou grupo, ela tende a aumentar de cima para baixo;
- Em uma mesma camada, ela tende a aumentar da direita para a esquerda.
Massa Atômica
Toda unidade de medida surgiu de uma convenção. A massa atômica é a média ponderada dos isótopos naturais de um determinado elemento. A massa atômica convencionou – se da divisão do átomo de carbono em 12 unidades (u).
O átomo de Carbono 12C possui massa de 1,992648 x 10-23g , portanto, 1u de carbono tem a massa de 1,66054 x 10-24g.
Exemplo: O elemento Cloro ocorre naturalmente na seguinte proporção: 75,78% de 35Cl (34,969 u) e 24,22% (36,969 u) de 37Cl (36,966 u). Portanto, a massa do cloro será:
Massa do Cloro = ![]() = 35,453u
= 35,453u
Dessa forma, a periodicidade da massa atômica ocorre da seguinte forma:
- Em uma mesma família ou grupo, ela tende a aumentar de cima para baixo;
- Em uma mesma camada, ela tende a aumentar da esquerda para a direita.
Volume atômico
O volume atômico está relacionado ao espaço que 1 de determinado átomo ocupa no espaço.
Quando percorremos a tabela periódica de cima para baixo, há o aumento dos níveis de energia, e, consequentemente, aumento do volume atômico.
Vimos anteriormente que a afinidade eletrônica cresce da esquerda para a direita. Ou seja, os átomos da esquerda tendem a doar elétrons, os átomos da direita tendem a receber elétrons, e os átomos centrais tendem a fazer ligações metálicas e compartilhar elétrons entre si.
Dessa forma, a periodicidade do volume atômico ocorre da seguinte forma:
- Em uma mesma família ou grupo, ela tende a aumentar de cima para baixo;
- Em uma mesma camada, ela tende a aumentar do centro para as extremidades esquerda e direita.
Densidade Atômica
A densidade atômica é dada pela relação entre massa e volume. Essa propriedade também é dada não só em função de um átomo, mas sim por 1 mol.
Dessa forma, a periodicidade do volume atômico ocorre da seguinte forma:
- Em uma mesma família ou grupo, ela tende a aumentar de cima para baixo;
- Em uma mesma camada, ela tende a aumentar das extremidades esquerda e direita em direção ao centro.
Ponto de fusão e ebulição
O ponto de fusão refere - se à temperatura em que determinado material passa do estado sólido para o líquido; e o ponto de ebulição é a máxima temperatura em que um material pode existir na fase líquida, antes de passar ao estado gasoso, sob uma determinada pressão. Essas propriedades dependerão das forças intermoleculares, e quanto mais forte elas forem, mais energia será necessária para que as mudem de estado.
Dessa forma, a periodicidade do volume atômico ocorre da seguinte forma:
- Em uma mesma família ou grupo, ela tende a aumentar de cima para baixo, com exceção dos dois primeiros grupos que aumentam de baixo para cima;
- Em uma mesma camada, ela tende a aumentar das extremidades esquerda e direita em direção ao centro.
Agora que você está sabendo tudo sobre distribuição eletrônica e Tabela periódica, recomendamos que vocês respondam as questões propostas para uma melhor compreensão dos conhecimentos obtidos!!! observação (clicar): é importante que vocês tenham uma tabela periódica em mãos e sempre revejam os conceitos quando sentirem dificuldades!)
Todos os direitos reservados. Proibida a reprodução total ou parcial sem indicação da fonte. Nenhuma parte do material disponível no site do Cursinho Popular IFSP Itapetininga pode ser reproduzida para fins comerciais. Copyright © Cursinho Popular IFSP Itapetininga 2021.
Exercícios
Como citar este documento: CALEGARI, Marcos Antonino; DA ROZ, Alessandra Luzia; MONTEIRO, Wallasse Gleison Romão; DIAS, Lucas Ferreira da Silva Borges. Distribuição eletetrônica. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/distribuicao-eletronica.html. Acesso em: [data de acesso].
1) (ENEM – 2017) No ar que respiramos existem os chamados “gases inertes”. Trazem curiosos nomes gregos, que significam “o Novo”, “o Oculto”, “o Inativo”. E de fato são de tal modo inertes , tão satisfeitos em sua condição, que não interferem em nenhuma reação química, não se combinam com nenhum outro elemento e justamente por esse motivo ficaram sem ser observados durante séculos: só em 1962 um químico, depois de longos e engenhosos esforços, conseguiu forçar “o Estrangeiro” (o xenônio) a combinar-se fugazmente com o flúor ávido e vivaz, e a façanha pareceu tão extraordinária que lhe foi conferido o Prémio Nobel.
LEVI, P. A tabela periódica. Rio de Janeiro: Relume-Dumará, 1994 (adaptado).
Qual propriedade do flúor justifica sua escolha como reagente para o processo mencionado?
A) Densidade.
B) Condutância.
C) Eletronegatividade.
D) Estabilidade nuclear.
E) Temperatura de ebulição.
2) (Unitau/Inverno 2016) - Um elemento químico X apresenta configuração eletrônica 1s2 2s2 2p4. Podemos afirmar que, na tabela periódica, esse elemento químico está localizado no
a) 2º período, família 6A.
b) 3º período, família 6A.
c) 2º período, família 7A.
d) 3º período, família 7A.
e) 4º período, família 5A.
3) (UEBA) - Um átomo apresenta normalmente 2 elétrons na primeira camada, 8 elétrons na segunda, 18 elétrons na terceira camada e 7 na quarta camada. A família e o período em que se encontra esse elemento são, respectivamente:
a) família dos halogênios, sétimo período
b) família do carbono, quarto período
c) família dos halogênios, quarto período
d) família dos calcogênios, quarto período
e) família dos calcogênios, sétimo período
4) (UDESC 2018) Analise as proposições em relação aos átomos na classificação periódica dos elementos químicos.
I. Os átomos do tálio são maiores que os átomos do bário.
II. Os átomos do germânio são mais eletronegativos que os de carbono.
III. A configuração eletrônica dos átomos de titânio, em ordem crescente de energia, é 1s22s22p63s23p64s23d2.
IV. Os átomos de bromo são os mais eletronegativos do quarto período da tabela periódica.
Assinale a alternativa correta.
A) Somente a afirmativa II é verdadeira.
B) Somente as afirmativas I e IV são verdadeiras.
C) Somente as afirmativas III e IV são verdadeiras.
D) Somente as afirmativas I e III são verdadeiras.
E) Somente a afirmativa III é verdadeira.
5) (URCA/CE) - Quando colocadas em ordem crescente, de subníveis energéticos, as seguintes configurações eletrônicas:
I. 2p6 2s2 1s2 3p6 3s2 4s2
II. 3p6 5s1 4s2 2p6 1s2 4p6 3d10 2s2 3s2
III. 3s2 1s2 3d10 2p6 2s2 4p6 3p6 4s2
IV. 3d10 2s2 4s2 2p6 1s2 4p5 3p6 3s2
Elas representam, respectivamente:
a) alcalino-terroso, alcalino, calcogênio e halogênio.
b) alcalino-terroso, alcalino, gás nobre e halogênio.
c) halogênio, calcogênio, alcalino e gás nobre.
d) gás nobre, alcalino-terroso, halogênio e calcogênio.
e) alcalino-terroso, halogênio, calcogênio e gás nobre
Bibliografia Consultada
A TABELA periódica, camadas eletrônicas e orbitais. Khan Academy 7
ALEXANDRE Chancourtois. In: WIKIPÉDIA: a enciclopédia livre. [São Francisco, CA: Fundação Wikimedia], 2021. 8
DMITRI Mendeleev. In: WIKIPÉDIA: a enciclopédia livre. [São Francisco, CA: Fundação Wikimedia], 2021. 9
FRIEDRICH Hund. In: WIKIPÉDIA: a enciclopédia livre. [São Francisco, CA: Fundação Wikimedia], 2021. 100
HENRY Moseley. In: WIKIPÉDIA: a enciclopédia livre. [São Francisco, CA: Fundação Wikimedia], 2021. 11
JOHANN Wolfgang Döbereiner. In: WIKIPÉDIA: a enciclopédia livre. [São Francisco, CA: Fundação Wikimedia], 2021. 12
JOHN Newlands. In: WIKIPÉDIA: a enciclopédia livre. [São Francisco, CA: Fundação Wikimedia], 2021. 13
LINUS Pauling. In: WIKIPÉDIA: a enciclopédia livre. [São Francisco, CA: Fundação Wikimedia], 2021. 14
MOTA, Cláudio J. A.; ROSENBACH JR., Nilton; PINTO, Bianca P. Química e Energia: transformando moléculas em desenvolvimento. São Paulo: SBQ, 2010. v. 2.
REIS, Martha. Química: meio ambiente, cidadania e tecnologia. São Paulo: Editora FTD, 2010. v. 1. p. 235- 261.
WOLFGANG Paulii. In: WIKIPÉDIA: a enciclopédia livre. [São Francisco, CA: Fundação Wikimedia], 2021. 15
Todos os direitos reservados. Proibida a reprodução total ou parcial sem indicação da fonte. Nenhuma parte do material disponível no site do Cursinho Popular IFSP Itapetininga pode ser reproduzida para fins comerciais. Copyright © Cursinho Popular IFSP Itapetininga 2021.