
Componentes da matéria
IFSP - Cursinho Popular
Como citar este documento: SILVA, André Coelho da; CARVALHO, Raquel Aparecida de; KLETTINGER, Leonardo. Componentes da Matéria. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/componentes-materia.html. Acesso em: [data de acesso].
- CONTEÚDO PROGRAMÁTICO
- Partículas elementares
- Forças fundamentais
- Radioatividade
- OBJETIVOS DESTE TEXTO
Com base nos tópicos abordados, esperamos que você possa:
- Compreender o que é uma partícula elementar;
- Conhecer algumas das partículas existentes, identificando quais são e quais não são elementares;
- Conhecer a nomenclatura e algumas características de categorias criadas para agrupar as partículas;
- Notar como as ideias científicas têm sido desenvolvidas ao longo do tempo no que tange ao estudo da matéria e seus constituintes;
- Conhecer quais são as quatro forças fundamentais da natureza;
- Compreender o que caracteriza um elemento radioativo, identificando a radioatividade como um fenômeno nuclear;
- Diferenciar radiações ionizantes de radiações não-ionizantes;
- Conhecer quais são os possíveis efeitos das radiações ionizantes sobre os seres humanos;
- Conhecer elementos históricos associados à descoberta e ao estudo da radioatividade;
- Compreender as características dos raios alfa, beta e gama emitidos por elementos radioativos;
- Compreender o fenômeno da transmutação radioativa e os diferentes tipos de decaimento radioativo;
- Compreender o conceito de meia-vida associado a elementos radioativos;
- Conhecer as três séries radioativas naturais.
Todos os direitos reservados. Proibida a reprodução total ou parcial sem indicação da fonte. Nenhuma parte do material disponível no site do Cursinho Popular IFSP Itapetininga pode ser reproduzida para fins comerciais. Copyright © Cursinho Popular IFSP Itapetininga 2021.
Partículas elementares
Como citar este documento: SILVA, André Coelho da; CARVALHO, Raquel Aparecida de; KLETTINGER, Leonardo. Componentes da Matéria. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/componentes-materia.html. Acesso em: [data de acesso].
Historicamente, filósofos gregos foram os primeiros a observar a quantidade e a variedade da matéria existente na natureza. Enquanto alguns propuseram que a matéria seria formada por combinações de elementos primordiais, como terra, água, fogo e ar, outros propuseram que ela seria formada por pequenas partículas invisíveis e indivisíveis. Neste grupo estavam Demócrito e Leucipo, que, por volta de 460 a.C., passaram a usar o termo “átomo” para designá-las. Vale dizer que em física de partículas, chamamos de partícula elementar uma partícula que não possui subestrutura: o átomo de Leucipo e Demócrito era tido como a partícula elementar.
As ideias atômicas não foram preponderantes durante a Idade Média, tampouco na Grécia Antiga. De fato, apenas no começo do século XX passa a haver consenso sobre a ideia de que a matéria convencional é feita de átomos e que estes são reais. Antes disso, no século XIX, cientistas já haviam detectado dezenas de átomos, sempre de forma “indireta”, uma vez que não é possível enxergar um átomo – um dos motivos da polêmica sobre sua real existência. Com o passar do tempo, a quantidade de átomos conhecidos foi aumentando. Paralelamente a isso, estudos evidenciaram que todos os átomos são compostos por partículas ainda menores, os elétrons, os prótons e os nêutrons. Cai por terra, portanto, a noção de que o átomo é indivisível: ele não é um tijolinho fundamental da matéria, pois possui constituintes internos.
Hoje sabemos que a divisão atômica é feita da seguinte forma:
na parte central do átomo está o núcleo, composto por prótons e nêutrons (a exceção é o núcleo do átomo de Hidrogênio, composto apenas por um próton). Mas tanto prótons quanto nêutrons também possuem estrutura interna, ou seja, são formados por partículas ainda menores: os quarks. Os quarks são exemplos de partículas tidas na atualidade como elementares. Trata-se de partículas com carga elétrica fracionária em termos da carga elétrica fundamental (e = 1,6.10-19 C). Seis quarks são conhecidos atualmente, entre eles os quarks up e down, que formam os prótons e os nêutrons. Estes possuem cargas elétricas de +2e/3 e -e/3, respectivamente. Um próton é formado por dois quarks up e um quark down. Por sua vez, um nêutron é formado por dois quarks down e um quark up. Quarks nunca foram detectados isoladamente, somente como constituintes de partículas maiores.
O elétron, a outra partícula presente no átomo, não no núcleo, mas sim nas vizinhanças do mesmo, também é uma partícula elementar. Ou seja: elétrons não possuem estrutura interna. Nesse sentido, há que se dizer que um dos objetivos da física de partículas é o de encontrar as partículas mais elementares, as que constroem todas as outras e não são compostas por partículas menores.
Os conhecimentos vigentes na física de partículas indicam que toda partícula possui sua antipartícula correspondente. A diferença entre elas está no sinal da carga elétrica. Assim, ao próton está associada sua antipartícula: o antipróton, que nada mais é que um próton com carga elétrica negativa. Ao elétron está associada sua antipartícula: o antielétron, também chamado de pósitron, que nada mais é que um elétron com carga positiva. A mesma lógica vale para os quarks: todo quark possui um antiquark correspondente. A união entre um quark e um antiquark forma partículas classificadas como mésons. Um exemplo é o píon, descoberto pelo físico brasileiro César Lattes na década de 1940. A união de três quarks forma partículas classificadas como bárions. Exemplos são os prótons e nêutrons. Já a união e três antiquarks forma partículas classificadas como anti-bárions, como os antiprótons e antinêutrons.
Todos os direitos reservados. Proibida a reprodução total ou parcial sem indicação da fonte. Nenhuma parte do material disponível no site do Cursinho Popular IFSP Itapetininga pode ser reproduzida para fins comerciais. Copyright © Cursinho Popular IFSP Itapetininga 2021.
Forças fundamentais
Como citar este documento: SILVA, André Coelho da; CARVALHO, Raquel Aparecida de; KLETTINGER, Leonardo. Componentes da Matéria. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/componentes-materia.html. Acesso em: [data de acesso].
As forças fundamentais estão ligadas às interações presentes em toda a matéria e são aquelas que não podem ser descritas com base em outras forças. Podemos pensá-las como as forças elementares. De fato, existem quatro forças fundamentais: a gravitacional, a eletromagnética, a nuclear forte e a nuclear fraca. Cada uma dessas forças atua sobre um ou mais tipos de partículas.
A força gravitacional é sempre atrativa e atua entre todas as partículas que possuem massa (férmions) – os fótons (partículas de luz), por exemplo, não possuem massa, logo, a força gravitacional não age sobre eles. Trata-se da mais fraca de todas as forças fundamentais, sendo inexpressiva em níveis atômicos e moleculares. Apesar de sua pequena intensidade em relação às outras forças, apresenta o maior alcance (estendendo-se ao infinito) entre todas as forças fundamentais e é a responsável por dar forma aos planetas, sistemas planetários, estrelas e até mesmo galáxias. A força gravitacional (FG) é inversamente proporcional ao quadrado da distância entre os corpos, conforme proposto por Isaac Newton e formalizado na equação:![]()
Nela, m1 e m2 são as massas dos corpos que estão interagindo gravitacionalmente; d é a distância entre eles e G é a constante gravitacional universal, cujo valor aproximado é de 6,67.10-11 m3.kg-1.s-2.
A título de exemplo, podemos calcular a força gravitacional entre o planeta Terra e a Lua, seu satélite natural. Suas massas aproximadas são de, respectivamente, 5,97.1024 kg e 7,35,1022 kg. Já a distância média entre tais corpos celestes é de 3,84.108 m. Colocando os valores na equação teremos:
![]() = 1,985.1020 N (Newtons é a unidade de medida de força no Sistema Internacional de Unidades de Medida)
= 1,985.1020 N (Newtons é a unidade de medida de força no Sistema Internacional de Unidades de Medida)
Já a força gravitacional entre duas pessoas, uma com m = 80 kg e outra com m = 60 kg, separadas por uma distância de 1 metro seria de:
![]() = 3,20.10-7 N
= 3,20.10-7 N
Trata-se de um valor relativamente pequeno, o que explica porque não notamos as forças gravitacionais que existem entre nós e os objetos ao nosso redor.
Atualmente, a força gravitacional é explicada a partir da Teoria da Relatividade Geral, de Albert Einstein, que afirma que grandes massas são capazes de distorcer a geometria do espaço-tempo. A propriedade responsável pela intensidade dessa interação é a massa/energia dos corpos.
A força eletromagnética pode ser tanto repulsiva quanto atrativa, dependendo do sinal das cargas elétricas e/ou polos magnéticos que estão interagindo entre si. A força eletrostática é descrita pela Lei de Coulomb e formalizada na seguinte equação:
![]()
Nela, q1 e q2 são as cargas elétricas resultantes dos corpos que estão interagindo eletricamente (medidas em Coulomb = C); d é a distância entre eles e k é a constante eletrostática, cujo valor varia dependendo do meio em que os corpos estão localizados. Seu valor aproximado no vácuo e no ar é de 9.109 N.m2/C2.
Quando comparada à força gravitacional, a força eletromagnética é muito mais intensa. Ela também atua em longas distâncias (estendendo-se ao infinito). Ainda assim, em níveis macroscópicos, a força eletromagnética tende a ser nula devido à neutralidade elétrica/magnética da matéria, o que explica porque é mais comum observarmos interações gravitacionais que eletromagnéticas.
A força nuclear forte possui esse nome devido a sua grande intensidade, sendo responsável por manter os núcleos atômicos unidos. Vale lembrar que nos núcleos atômicos há prótons e nêutrons. Como os prótons possuem carga elétrica positiva, há uma grande força de repulsão entre eles, o que tenderia a tornar o núcleo instável. Assim, a força nuclear forte é uma força de atração entre os constituintes do núcleo (prótons e nêutrons), contrabalanceando a força de repulsão elétrica. Trata-se de uma força de curto alcance, cerca de 10-15 m. Núcleos atômicos muito maiores que isso tendem a ser instáveis, pois, nesse caso, a força eletrostática é predominante. Trata-se da mais forte de todas as interações da natureza. Além disso, os hádrons, como prótons e nêutrons, são formados por trios de quarks, os quais se atraem pela ação da força forte, que é mediada por bósons chamados de glúons. A força forte não atua entre os léptons (elétrons, neutrinos, múons, taúons), pois eles não possuem a propriedade que define a intensidade da força forte: a carga cor. Ou seja: da mesma forma que a força elétrica só atua em partículas que possuem carga elétrica, a força forte só atua em partículas que possuem carga cor.
A força nuclear fraca age entre os dois tipos de férmions: léptons e quarks. É a força responsável por um dos tipos de decaimento radioativo, realizando a transformação de um tipo de quark em outro por meio da emissão de elétrons ou de pósitrons (antielétrons). É cerca de um milhão de vezes mais fraca que a força forte e o seu alcance é ainda menor, de apenas 10-18 m.
A teoria da Física de partículas atual que reúne as interações da natureza, bem como as suas partículas mediadoras e interagentes, é chamada de Modelo Padrão. Trata-se de um campo alvo de muitas pesquisas atuais, tanto em termos experimentais quanto em termos teóricos.Todos os direitos reservados. Proibida a reprodução total ou parcial sem indicação da fonte. Nenhuma parte do material disponível no site do Cursinho Popular IFSP Itapetininga pode ser reproduzida para fins comerciais. Copyright © Cursinho Popular IFSP Itapetininga 2021.
Radioatividade
Como citar este documento: SILVA, André Coelho da; CARVALHO, Raquel Aparecida de; KLETTINGER, Leonardo. Componentes da Matéria. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/componentes-materia.html. Acesso em: [data de acesso].
De forma aproximada, podemos considerar um átomo como sendo composto por um núcleo com carga elétrica positiva que, embora possua dimensões muito reduzidas em relação ao átomo como um todo (cerca de cem milésimos), concentra praticamente toda sua massa. Ao redor do núcleo encontram-se elétrons, partículas com carga elétrica negativa. Um átomo possui também muito espaço vazio.
O núcleo atômico é formado por prótons e, na maioria dos átomos, também por nêutrons. Essas partículas se atraem firmemente devido à ação da chamada força nuclear forte, que é uma força de atração entre os constituintes do núcleo. Por outro lado, como os prótons têm carga elétrica positiva eles se repelem eletricamente. Logo, o nível de estabilidade do núcleo atômico tem relação com o balanço entre a força nuclear forte e a força elétrica. Se elas não se equilibrarem, o núcleo passa a ter excesso de energia, tornando-se instável, isto é, radioativo. Em outras palavras: um elemento radioativo nada mais é que um elemento que possui núcleo atômico instável. Até por isso, a Radioatividade pode ser chamada de um fenômeno nuclear.
Embora também possa ser induzida, a Radioatividade existe de forma natural no planeta Terra desde a sua formação. Trata-se do fenômeno pelo qual certos núcleos atômicos instáveis (excesso de energia) emitem partículas e radiações eletromagnéticas espontaneamente com o objetivo de se tornarem estáveis.
Antes de nos aprofundarmos no estudo da Radioatividade, vale a pena distinguirmos a diferença entre radiações ionizantes e radiações não ionizantes.
Radiações ionizantes são aquelas que têm energia suficiente para arrancar elétrons dos átomos, tornando-os íons (espécies químicas eletrizadas, isto é, com carga elétrica resultante não-nula). Entre elas estão os raios X e os raios gama. Já as radiações não ionizantes são aquelas que não têm energia suficiente para arrancar elétrons dos átomos. Entre elas estão: as ondas de rádio, a luz visível, as microondas e a radiação infravermelha. A radiação ultravioleta pode ser ionizante ou não ionizante, dependendo de sua frequência (Figura 1). Por esse motivo, a exposição excessiva à radiação solar, especialmente em alguns horários do dia sem o uso do protetor solar, pode causar alguns tipos de cânceres. Entre eles, o câncer de pele – segundo dados do Instituto Nacional de Câncer (INCA), o câncer de pele é o mais frequente no Brasil e no mundo, responsável por 27% dos cânceres no país.
Figura 1 - Espectro eletromagnético – radiações não ionizantes e radiações ionizantes
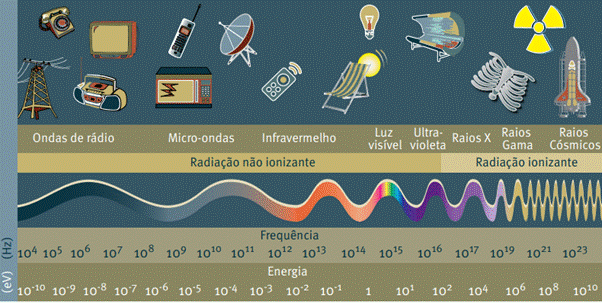
Fonte: United Nations Environmet Programme (2016)
No corpo dos seres humanos os átomos estão unidos, formando moléculas. Algumas são relativamente pequenas, como a da água. Outras, relativamente grandes, como a do DNA. As moléculas do nosso corpo podem ser danificadas quando uma radiação ionizante arranca um elétron de um dos átomos que a compõem. De fato, os efeitos das radiações ionizantes nas células podem ser diretos, pela danificação de uma macromolécula como DNA, proteína, enzima, entre outras; ou indiretos, pela interação da radiação com o meio e a produção de radicais livres (átomos/moléculas altamente reativos). Essas modificações celulares podem ser reparadas pelo próprio organismo. Caso isso não ocorra, surgirão lesões bioquímicas que podem levar à morte prematura da célula, a alterações no processo de divisão celular e a alterações genéticas.
Os efeitos biológicos provocados pela interação das radiações ionizantes com a matéria podem ser de dois tipos: determinísticos e estocásticos. A principal diferença entre eles é que os efeitos estocásticos causam a transformação celular, o que, a longo prazo, poderá levar ao desenvolvimento de tumores; e os determinísticos causam a morte celular, o que, a curto prazo, implica em danos como queimaduras, queda de cabelo, tontura, mal-estar e até mesmo a morte da pessoa.
Embora raios X e radioatividade não sejam sinônimos, a descoberta desta esteve relacionada à descoberta dos raios X. De fato, em 1896, no ano seguinte à descoberta dos raios X por Röntgen, um cientista francês chamado Henri Becquerel notou, um tanto por um acaso, que o urânio e seus compostos são capazes de emitir de forma espontânea radiações altamente energéticas e capazes de penetrar distâncias consideráveis na matéria. Essa radiação ficou conhecida na época como raios de Becquerel ou raios do urânio.
O próprio Becquerel não deu sequência às suas pesquisas, desinteressando-se pelo tema. Isso coube a uma jovem estudante de doutorado, a física e química polonesa, Marie Curie. Marie estudou diversos elementos químicos conhecidos naquela época, evidenciando que a emissão espontânea de radiações energéticas não era exclusividade do urânio, pois ocorria também no tório. Posteriormente, Marie, em conjunto com outros cientistas, entre eles seu marido, Pierre Curie, descobriram e foram capazes de isolar novos elementos químicos, nomeando-os de polônio e rádio. Ambos apresentavam a mesma propriedade de emitirem espontaneamente radiações altamente energéticas. Desde então, o fenômeno dos raios de Becquerel ou raios do urânio foi rebatizado por Marie Curie de Radioatividade. Similarmente, os materiais capazes de emitir tais raios passaram a ser chamados de materiais radioativos ou elementos radioativos.
Outro cientista que estudou a Radioatividade e teve grandes contribuições nesta área foi o físico neozelandês Ernest Rutherford. Logo no início de suas pesquisas com os compostos do urânio, Rutherford percebeu que a radiação emanada pelos mesmos tinha um alto poder de penetração e que para barrá-las eram necessárias placas de chumbo com alguns centímetros de espessura. Rutherford e seus colegas de laboratório prepararam então um experimento para tentarem compreender melhor as características dessa radiação. Numa caixa de chumbo com um pequeno orifício, colocaram diferentes amostras radioativas. Entre a caixa e o detector (uma placa fotográfica), criaram uma região com um campo elétrico. Assim, radiações emitidas pelos elementos radioativos passavam pelo orifício da caixa, atravessavam a região do campo elétrico e atingiam a placa fotográfica. Com certa surpresa, notaram que essas radiações podiam seguir três trajetórias distintas, conforme exibe Figura 2, a seguir.
Figura 2 - Ilustração do experimento realizado por Rutherford e seus colegas de laboratório
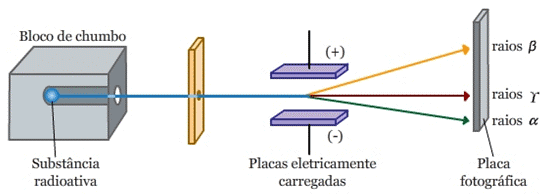
Fonte: Professor Atômico (2015). 2 . Acesso em: 04 fev. 2021.
Num primeiro momento, com os resultados desse experimento, Rutherford estabeleceu que os elementos radioativos poderiam emitir dois tipos de radiação: uma era rapidamente absorvida, a qual, ele chamou de radiação alfa (α) e a outra era mais penetrante, batizada de radiação beta (β).
As diferentes trajetórias das radiações alfa e beta como ilustrado na Figura 2, se devem ao fato de que elas são partículas com diferentes propriedades físicas. Em específico, as partículas alfa são eletricamente positivas e as partículas beta, ao menos as detectadas por Rutherford, são eletricamente negativas.
Em 1900, o físico e químico francês, Paul Villard identificou a existência de um terceiro tipo de radiação muito mais penetrante que as radiações encontradas anteriormente. Somente três anos depois, Rutherford nomeou-a de radiação gama (γ), que, ao contrário dos dois primeiros tipos, não sofria desvio algum com o campo elétrico do experimento – o que evidencia que se trata de uma radiação sem carga elétrica resultante. Foi Rutherford quem estabeleceu que a radiação gama é uma onda eletromagnética da mesma natureza que os raios X. Por se tratar de uma radiação eletromagnética (luz), os raios gama se propagam com a velocidade da luz (aproximadamente 300.000 Km/s, no vácuo). Vale frisar que nenhum elemento radioativo é capaz de emitir raios X, ou seja: não se pode confundir raios X com radioatividade, tampouco raios X com as radiações emitidas pelos elementos radioativos (alfa, beta e gama).
Como vimos no início do texto, núcleos de átomos com excesso de energia tendem a buscarem a estabilidade por meio da emissão de radiações corpusculares (partículas alfa e beta) e/ou de radiações eletromagnéticas (raios gama). Quando são emitidos raios alfa ou beta, há uma variação no número de prótons do núcleo, isto é, o elemento se transforma em outro. Esse processo costuma ser chamado de transmutação radioativa, desintegração radioativa ou decaimento radioativo.
As partículas alfa são compostas por dois prótons e dois nêutrons. Devido à massa relativamente elevada e à carga elétrica duplamente positiva, elas interagem em maior escala com os átomos ao redor. Essa interação reduz rapidamente a energia da partícula, reduzindo seu poder de penetração na matéria. De fato, partículas alfa podem ser bloqueadas, por exemplo, por uma folha de papel sulfite.
As partículas beta são elétrons com velocidade próxima à velocidade da luz. Possuem, portanto, carga elétrica negativa. São mais penetrantes que as partículas alfa por terem massa e carga elétrica relativamente menores. Elas podem atravessar um ou dois centímetros de tecido vivo.
Os raios gama são extremamente penetrantes e podem atravessar qualquer material menos denso do que uma chapa de aço.
A Figura 3, a seguir, exibe o poder de penetração das partículas alfa e beta e da radiação gama. Observe que as partículas alfa são barradas por uma folha de papel sulfite, já as partículas beta atravessam a folha de papel sulfite sem qualquer problema e são barradas por uma chapa de alumínio com alguns centímetros de espessura. A radiação gama é mais penetrante, sendo barrada apenas por uma chapa de cumbo com alguns centímetros de espessura.
Figura 3 - Poder de penetração das radiações alfa, beta e gama
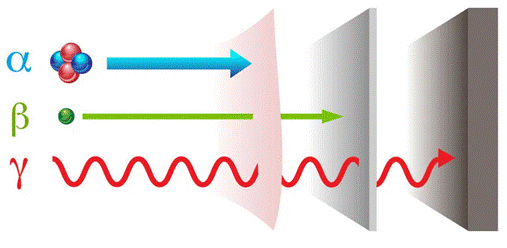
Fonte: Helerbrock ([20--]). 3. Acesso em: 04 fev. 2021.
A seguir, estudaremos as transmutações dos elementos radioativos. Veremos o que acontece com o núcleo do átomo quando este emite partículas alfa ou beta ou radiação gama.
Sempre que um elemento radioativo emitir uma partícula alfa, ele terá uma redução no número de massa em quatro unidades e uma redução no número atômico em duas unidades. Observe a Equação (1), a seguir. O urânio-238, número atômico 92, ao emitir uma partícula alfa se transforma no elemento tório-234, número atômico 90.
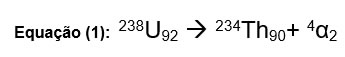
Ao invés de emitirem raios alfa (podemos chamá-los também de partículas alfa ou radiação alfa), certos elementos radioativos emitem raios beta (podemos chamá-los também de partículas beta ou radiação beta). Um raio beta nada mais é que um elétron. Mas como é possível que um núcleo atômico radioativo emita um elétron se não há elétrons no núcleo? Quem esclareceu este fenômeno foi o físico italiano Enrico Fermi. Fermi percebeu que o elétron emitido de dentro do núcleo na forma de radiação beta é resultado da quebra de um nêutron. Quando há a quebra de um nêutron, este, imediatamente se transforma em um elétron e um próton. Como o elétron formado é expulso do núcleo, o núcleo fica com um próton a mais e um nêutron a menos (já que este se transformou num próton). Em consequência, quando o elemento radioativo emite uma partícula beta, ele tem o aumento de uma unidade no número atômico, como exibe Equação (2), a seguir. Exemplo: o carbono-14, número atômico 6, ao emitir uma partícula beta se transforma no elemento nitrogênio-14, número atômico 7. Note que o número de massa não se altera, permanecendo igual ao do elemento anterior. Isso porque o número de massa diz respeito à soma de prótons e nêutrons. Como o decaimento beta envolve ganhar um próton e perder um nêutron, a soma de suas quantidades não se altera.
![]()
Por fim, elementos radioativos podem emitir também raios gama. Esse tipo de emissão não é representado na forma de equação porque os raios gama não possuem cargas elétricas, tampouco massa. De fato, enquanto um tipo de luz (radiação eletromagnética), a emissão de raios gama não altera nem o número de massa nem o número atômico do elemento radioativo responsável por sua emissão. Trata-se, assim, de um meio utilizado por um núcleo radioativo (núcleo instável, com excesso de energia) para reduzir sua energia.
A rapidez associada ao decaimento dos elementos radioativos varia muito. Pode ocorrer em questão de milissegundos ou em questão de bilhões de anos. O tempo necessário para que a atividade de um elemento radioativo seja reduzida pela metade da atividade inicial é chamado de meia-vida. Isso significa que, para cada meia-vida que passa, a atividade vai sendo reduzida à metade da anterior, até atingir um valor insignificante. O raciocínio pode ser feito também em termos da massa/quantidade de núcleos radioativos. A cada meia-vida, a massa/quantidade de núcleos cai pela metade. Não significa que a massa sumiu, que os elementos radioativos vão desaparecendo. Mas sim, que eles se transformaram em outros elementos (transmutação) quando emitem radiação alfa ou beta.Um exemplo prático: o iodo-131 é utilizado na Medicina Nuclear para exames de tireóide (o paciente a ser examinado ingere o elemento radioativo). Ele possui meia-vida de 8 dias. Isso significa que, decorridos 8 dias, a atividade radioativa será reduzida pela metade. Passados mais 8 dias, cairá à metade desse valor, ou seja, a um quarto da atividade inicial e assim sucessivamente. Após 80 dias (10 meias-vidas), atingirá um valor cerca de 1000 vezes menor. Em termos de massa, supondo que o paciente tenha ingerido 6 g de iodo-131, após 8 dias, haverá apenas 3 g de iodo-131. Após mais 8 dias, 1,5 g e assim por diante.
Na natureza existem elementos radioativos que realizam transmutações ou desintegrações sucessivas, até que o núcleo atinja uma configuração estável. Isso significa que, após um decaimento radioativo, o núcleo não possui, ainda, uma organização interna estável e, assim, ele executa outra transmutação para melhorá-la e, ainda não conseguindo, prossegue, até atingir a configuração de equilíbrio. Em cada decaimento, os núcleos emitem radiações. Essas sequências de decaimentos são denominadas: Séries Radioativas ou Famílias Radioativas Naturais.
Com o estudo da Radioatividade, verificou-se que existem três séries radioativas naturais, conhecidas como: Série do Urânio, Série do Actínio e Série do Tório. A Série do Actínio, na realidade, inicia-se com o urânio-235 e tem esse nome, porque se acreditava que ela começava pelo actínio-227.
As três séries naturais terminam em isótopos estáveis do chumbo, respectivamente, chumbo-206, chumbo-207 e chumbo-208. A Figura 4, a seguir, mostra boa parte de cada uma dessas séries radioativas naturais.
Figura 4 - Séries radioativas naturais do urânio-238, actínio-227 e tório-232
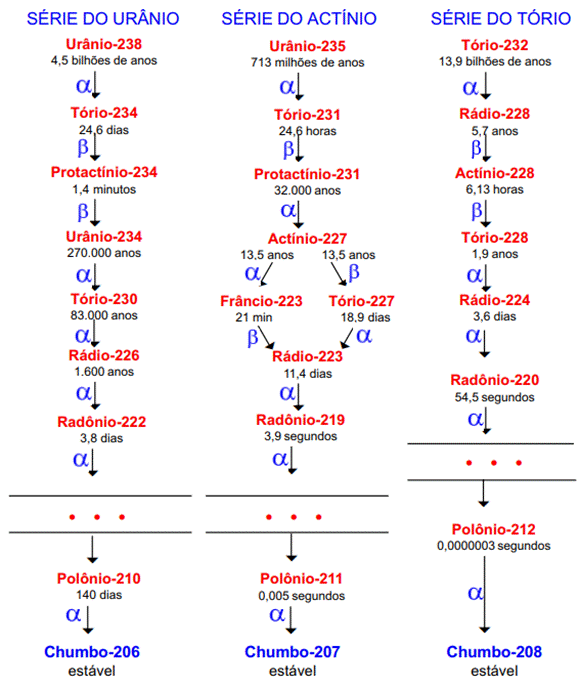
Fonte: Cardoso ([20--]).
Alguns elementos radioativos têm meia-vida longa, como os elementos iniciais de cada série radioativa natural: urânio-235, urânio-238 e tório-232. Dessa forma, é possível explicar porque na natureza há uma porcentagem baixa de urânio-235 em relação à de urânio-238 (menos de 1% contra mais de 99%). Como a meia-vida do urânio-235 é de 713 milhões de anos e a do urânio-238 é de 4,5 bilhões de anos, o urânio-235 decai mais rapidamente e, portanto, já transmutou-se em outros elementos numa quantidade maior que o urânio-238.
Todos os direitos reservados. Proibida a reprodução total ou parcial sem indicação da fonte. Nenhuma parte do material disponível no site do Cursinho Popular IFSP Itapetininga pode ser reproduzida para fins comerciais. Copyright © Cursinho Popular IFSP Itapetininga 2021.
Bibliografia
Como citar este documento: SILVA, André Coelho da; CARVALHO, Raquel Aparecida de; KLETTINGER, Leonardo. Componentes da Matéria. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/componentes-materia.html. Acesso em: [data de acesso].
BIRAL, A. R. Radiações ionizantes para médicos, físicos e leigos. Florianópolis: Insular, 2002.
BRENNAN, R. P. Gigantes da Física: uma história da física moderna através de oito biografias. Rio de Janeiro: Zahar, 2012.
CHASSOT, A. I. Raios X e radioatividade. Química Nova na Escola, São Paulo, n. 2, p. 19-22, 1995. Disponível em: http://qnesc.sbq.org.br/online/qnesc02/historia.pdf. Acesso em: 04 fev. 2021.
CARDOSO, E. M. Radioatividade. Brasília, DF: Comissão Nacional de Energia Nuclear, [20--]. Disponível em: http://www.famema.br/projetos/comitepr/doc/Boletim_n%C2%BA_009_RADIOATIVIDADE_CNEN.pdf. Acesso em: 28 jan. 2021.
CORDEIRO, M. D.; PEDUZZI, L. O. Q. As conferências Nobel de Marie e Pierre Curie: a gênese da radioatividade no ensino. Caderno Brasileiro de Ensino de Física, Florianópolis, v. 27, n. 3, p. 473-514, 2010. DOI: https://doi.org/10.5007/2175-7941.2010v27n3p473. Acesso em: 04 fev. 2021.
INSTITUTO NACIONAL DE CÂNCER. Câncer de pele: saiba como prevenir, diagnosticar e tratar. INCA, Rio de Janeiro, 18 dez. 2020. Disponível em: https://www.inca.gov.br/noticias/cancer-de-pele-saiba-como-prevenir-diagnosticar-e-tratar. Acesso em: 28 jan. 2021.
LEYTON, F et al. Riscos da radiação X e a Importância da proteção radiológica na cardiologia intervencionista: uma revisão sistemática. Revista Brasileira de Cardiologia Invasiva, São Paulo, v. 22, n. 1, p. 87-98, 2014. DOI: https://doi.org/10.1590/0104-1843000000015. Disponível em: https://www.scielo.br/scielo.php?pid=S2179-83972014000100087&script=sci_abstract&tlng=pt. Acesso em: 04 fev. 2021.
MARQUES, D. M. As Investigações de Ernest Rutherford sobre a Estrutura da Matéria: contribuições para o ensino de química. 2006. 182f. Dissertação (Mestrado em Educação para a Ciência) – Faculdade de Ciências, Universidade Estadual Paulista, 2006. Disponível em: https://repositorio.unesp.br/handle/11449/90930. Acesso em: 04 fev. 2021.
MARTINS, R. A. As primeiras investigações de Marie Curie sobre elementos radioativos. Revista da Sociedade Brasileira de História da Ciência, São Paulo, v. 1, n. 1, p. 29-41, 2003. Disponível em: https://www.sbhc.org.br/revistahistoria/view?ID_REVISTA_HISTORIA=21. Acesso em: 04 fev. 2021.
MARTINS, R. A. Como Becquerel não descobriu a radioatividade. Caderno Brasileiro de Ensino de Física, Florianópolis, v. 7, n. especial, p. 27-45, 1990. DOI: https://doi.org/10.5007/%25x. Disponível em: https://periodicos.ufsc.br/index.php/fisica/article/view/10061. Acesso em: 04 fev. 2021.
MARTINS, R. A. Hipóteses e interpretação experimental: a conjectura de Poincaré e a descoberta da hiperfosforescência por Becquerel e Thompson. Ciência & Educação, Bauru, v. 10, n. 3, p. 501-516, 2004. DOI: http://dx.doi.org/10.1590/S1516-73132004000300013. Disponível em: https://www.scielo.br/scielo.php?pid=S1516-73132004000300013&script=sci_abstract&tlng=pt. Acesso em: 04 fev. 2021.
MERÇON, F.; QUADRAT, S. V. A Radioatividade e a história do tempo presente. Química Nova na Escola, n° 19, 27-30, 2004. Disponível em: http://qnesc.sbq.org.br/edicao.php?idEdicao=31. Acesso em: 04 fev. 2021.
MONTELES B. M et al. Radiações ionizantes a favor da vida. Revista Interdisciplinar de Ciências Médicas, Teresina, v. 1, n. 1, p. 1-5, 2017. Disponível em: https://gpicursos.com/interagin/gestor/uploads/trabalhos-feirahospitalarpiaui/cb0ac376e91c8b68e27a610a6d9bab5b.pdf. Acesso em: 04 fev. 2021.
OKUNO, E. Radiação ultravioleta: características e efeitos. São Paulo: Livraria da Física, 2005.
OKUNO, E. Radiação: efeitos riscos e benefícios. São Paulo: Harbra,1988.
OKUNO, E.; YOSHIMURA, E. M. Física das radiações. São Paulo: Oficina de Textos, 2010.
SILVA. A. A. Radiação ionizante e não ionizante. Belo Horizonte: PUC-MG, 1997.
UNITED NATIONS ENVIRONMENT PROGRAMME. Radiação: efeitos e fontes. Nairobi: UNEP, 2016. Disponível em: http://www.aben.com.br/Arquivos/544/544.pdf. Acesso em: 28 jan. 2021.
XAVIER, A. M et al. Marcos da história da radioatividade e tendências atuais. Química Nova na Escola, São Paulo, v. 30, n. 01, p.83-89, 2007. Disponível em: http://quimicanova.sbq.org.br/detalhe_artigo.asp?id=1709. Acesso em: 04 fev. 2021.Todos os direitos reservados. Proibida a reprodução total ou parcial sem indicação da fonte. Nenhuma parte do material disponível no site do Cursinho Popular IFSP Itapetininga pode ser reproduzida para fins comerciais. Copyright © Cursinho Popular IFSP Itapetininga 2021.