Cinética Química
IFSP - Cursinho Popular
Como citar este documento: MONTEIRO, Wallasse G. Romão. Reações redox. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/ cursinho/home/materias/reacoes-redox.html. Acesso em: [data de acesso].
Contextualização
A cinética química é o ramo da química que estuda a velocidade com que as reações químicas ocorrem e os fatores que a influenciam, tornando possível controlar sua velocidade, podendo deixá-la mais rápida ou mais lenta.
Cotidianamente muitas reações químicas estão presentes, com diferentes velocidades. Existem reações que são muito rápidas como a queima do gás de cozinha, por exemplo. Outras reações demoram muito tempo para ocorrer, como as reações que levam à formação do petróleo, por exemplo.
A importância de se estudar cinética química é justamente conhecer essas velocidades para poder interferir sempre que for necessário. Isso é muito comum na indústria, pois em alguns casos é importante que algumas reações ocorram rapidamente, já outras, que ocorram lentamente.
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Velocidade média de reação
Como citar este documento: LOMBARDI, Marina Salles Leite; SILVA, Juliano Ricciardi Floriano; SILVA, Eliabe Momberg da; ALCÂNTARA, Evelyn Karoline Gusson; PEREIRA, José Gustavo Leme; ARAÚJO, Marlene Aparecida. A evolução do capitalismo. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/capitalismo.html. Acesso em: [data de acesso].
Agora veremos como se calcula a velocidade média de reação. Usaremos a seguinte equação genérica para exemplificar melhor:
aA+bB → cC+dD
Na Física, você já deve ter ouvido falar em velocidade média, que é a variação do espaço pela variação do tempo (
Sendo |ΔQ| o módulo da variação da concentração do reagente ou produto, em
No caso do exemplo acima, podemos calcular a velocidade de reação - considerando também os coeficientes da equação balanceada - da seguinte forma:
Velocidade média de consumo do reagente A:
Velocidade média de consumo do reagente B:
Velocidade média de consumo do produto C:
Velocidade média de consumo do produto D:
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Reação química
Como citar este documento: LOMBARDI, Marina Salles Leite; SILVA, Juliano Ricciardi Floriano; SILVA, Eliabe Momberg da; ALCÂNTARA, Evelyn Karoline Gusson; PEREIRA, José Gustavo Leme; ARAÚJO, Marlene Aparecida. A evolução do capitalismo. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/capitalismo.html. Acesso em: [data de acesso].
Uma reação química é uma transformação da matéria em que ocorrem mudanças qualitativas na composição química de uma ou mais substâncias reagentes, resultando em um ou mais produtos. Para que ela ocorra, os reagentes presentes nas reações químicas devem ter afinidade química para reagirem.
Observe na figura 1, como em uma reação química ocorre a variação da quantidade de reagentes e produtos em função do tempo
Figura 1 - Variação da quantidade de reagentes e produtos em função do tempo
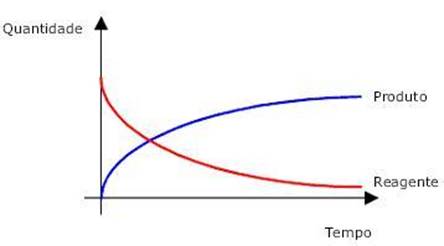
Fonte: Grupo Evolução (http://grupoevolucao.com.br/livro/Quimica3/qui3-c1.JPG)
Variação da entalpia (ΔH) é o termo empregado para designar a liberação ou o consumo de energia durante uma reação, isto é, a diferença da quantidade de energia dos produtos da reação (Hp) menos a quantidade de energia dos reagentes da reação (Hr):
![]()
Quando:
ΔH > 0, temos uma reação endotérmica, já que a energia do(s) produto(s) é maior que a energia do(s) reagente(s). Desta forma, ela precisa absorver calor do ambiente, ou seja, é necessário que haja fornecimento de energia para que a reação ocorra.
ΔH < 0, temos uma reação exotérmica, já que a energia do(s) reagente(s) é maior que a do(s) produto(s). Desta forma, a reação libera calor para o meio ambiente.
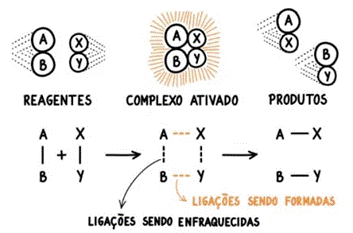
1) para que possam ocorrer colisões efetivas entre as moléculas. Dessa forma, rompem-se as ligações dos reagentes, formando as novas ligações que darão origem aos produtos;
2) Deve, necessariamente, haver entre os reagentes.
3) Para que uma reação química possa ocorrer também é necessário que os átomos, moléculas ou íons dos reagentes entrem em colisões, e isso é o que chamamos de
Considere a reação entre o gás hidrogênio e o iodo gasoso:
H2(g) + I2 (g) → 2HI (g)
Considerando o modelo atômico de Dalton e imaginando os átomos como esferas, a reação química pode ser representada de acordo a figura 2:
Figura 2 - Reação química representada por esferas
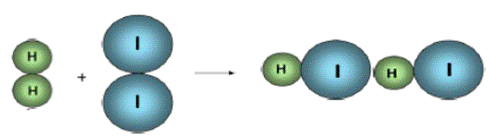
Fonte: Impacto (2009) (https://pt.scribd.com/doc/23288229/Teoria-das-Colisoes-afinidade-quimica)
Conforme dito, é necessário que os átomos, moléculas ou íons dos reagentes entrem em colisões. No entanto, nem toda colisão gera uma reação química, sendo necessária uma colisão efetiva que possui as seguintes características:
Para que esta reação, e qualquer outra, possam ocorrer, a teoria das colisões para as velocidades de reação estabelece as seguintes condições que devem ser satisfeitas:
a) Para que ocorra a reação é necessário que as moléculas reagentes colidam entre si. Observe na figura 3 como a colisão entre as moléculas de H2 e I2 resultam em 2 moléculas de HI.
Figura 3 - Colisão entre os reagentes gerando produtos
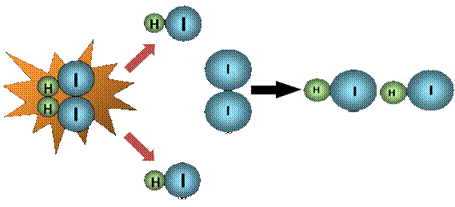
Fonte: Impacto (2009) (https://pt.scribd.com/doc/23288229/Teoria-das-Colisoes-afinidade-quimica)
Figura 4 - Colisão em orientação não adequada em A) e com orientação adequada em B)
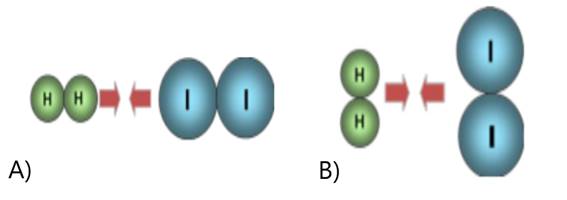
Fonte: Impacto (2009) (https://pt.scribd.com/doc/23288229/Teoria-das-Colisoes-afinidade-quimica)
c) Ainda, para que a colisão seja efetiva, as moléculas que colidem devem ter valores mínimos de energia, suficiente para promover choques efetivos, sendo que esta energia recebe o nome de energia de ativação.
Energia de ativação, que é a energia mínima que eu devo fornecer ao sistema para que a reação química ocorra. Quanto maior for a energia de ativação, mais lenta é a reação química. A energia de ativação também pode ser definida como a energia mínima necessária para a formação do .A energia de ativação é sempre igual à diferença entre a energia do complexo ativado e a dos reagentes. Portanto, quanto maior a energia de ativação de uma reação, menor será a velocidade dessa reação e vice-versa:
Energia (Ativação) = Energia (Complexo ativado) - Energia (Reagentes)
Nos gráficos da figura 6 podemos representar as reações químicas de uma maneira geral. Observe como essa energia de ativação (Ea) funciona como uma espécie de barreira que deve ser superada para que a reação ocorra.
Figura 6 - Representação da energia de ativação
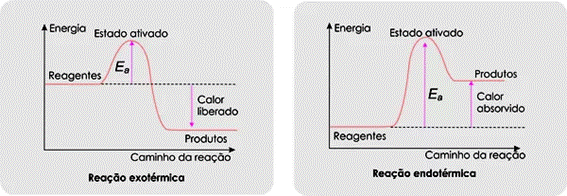
Fonte: Colégio Qi (http://educacao.globo.com/quimica/assunto/cinetica-quimica/fatores-que-influenciam-reacoes-quimicas.html)
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Fatores que influenciam na velocidade de reação
Como citar este documento: LOMBARDI, Marina Salles Leite; SILVA, Juliano Ricciardi Floriano; SILVA, Eliabe Momberg da; ALCÂNTARA, Evelyn Karoline Gusson; PEREIRA, José Gustavo Leme; ARAÚJO, Marlene Aparecida. A evolução do capitalismo. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/cursinho/home/materias/capitalismo.html. Acesso em: [data de acesso].
Conforme havíamos adiantado na introdução deste capítulo, é importante saber como interferir na velocidade de reação química, pois às vezes precisamos que ela ocorra com uma determinada velocidade. Portanto, neste tópico iremos conhecer quais são esses principais fatores que fazem com que uma reação química seja acelerada ou retardada.
Temperatura:
Um exemplo da influência da temperatura na velocidade das reações é o cozimento de alimentos em uma panela de pressão, em que o aumento da temperatura faz com que os alimentos cozinhem de forma mais rápida.
Superfície de contato:
As reações químicas ocorrem com as moléculas que ficam na superfície de contato. Dessa forma, quanto maior for a superfície de contato, maior é a chance de ocorrerem colisões efetivas (colisões com orientação adequada e energia suficiente) ocorrerem.
Se você colocar um comprimido inteiro em um copo de água e um comprimido triturado em pó, você perceberá que o comprimido em pó irá terminar de reagir primeiro. Isso ocorre justamente em função de sua área de contato com a água ser maior do que a área do comprimido inteiro.
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Concentração dos reagentes
Como citar este documento: MONTEIRO, Wallasse G. Romão. Reações redox. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/ cursinho/home/materias/reacoes-redox.html. Acesso em: [data de acesso].
Ao aumentarmos a concentração do reagente em um sistema, aumentamos a quantidade de moléculas desse reagente por unidade de volume. Dessa forma quanto maior a quantidade de moléculas, maior a quantidade de colisões efetivas.
Por exemplo, imagine uma reação de combustão ao ar livre e outra ocorrendo dentro de um recipiente fechado com gás oxigênio puro. A chama torna-se bem mais intensa quando a queima ocorre dentro do recipiente com oxigênio puro, ou seja, onde o combustível reage com 100% de moléculas de oxigênio. Já a queima ao ar livre tem-se que a composição do ar atmosférico é constituída majoritariamente por gás nitrogênio – cerca de 79% - e a concentração de oxigênio é de cerca de 20%, ou seja, tem menos moléculas de gás oxigênio por unidade de volume.
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Catalisadores
Como citar este documento: MONTEIRO, Wallasse G. Romão. Reações redox. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/ cursinho/home/materias/reacoes-redox.html. Acesso em: [data de acesso].
Catalisador é uma substância adicionada a uma reação química que possui a função de diminuir a energia de ativação e, consequentemente, aumentando a velocidade da reação. Contudo, o catalisador não participa da reação química, não alterando a composição química dos reagentes e produtos envolvidos.
Para que as células do nosso corpo consigam produzir energia para a nossa existência, é necessário que elas oxidem moléculas de glicose.
![]()
Essa reação de oxidação é termodinamicamente favorável a 25°C uma vez que ΔH <0 e isso torna a vida possível.
Observe na figura 7, a diminuição na energia de ativação que o catalisador promove na reação química, comparada à reação sem catalisador.
Figura 7 - Reação química com catalisador
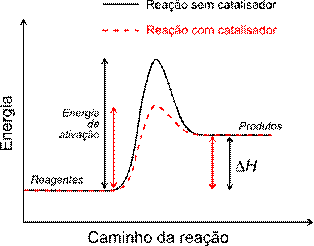
Fonte: Wikimedia Commons (2006, adaptada) (https://commons.wikimedia.org/wiki/File:Activation_energy.svg)
Luz:
Sabemos que a luz é uma energia na forma de onda eletromagnética. Assim, a luz também funciona diminuindo a energia de ativação fazendo com que reação química ocorra mais facilmente e, consequentemente, aumenta a velocidade da reação.
Um exemplo é a água oxigenada, que se decompõe mais facilmente quando exposta à presença de luz.
Pressão:
Para entendermos como a pressão influencia em um sistema gasoso, vamos relembrar a equação dos gases ideais, também conhecida como equação de
:
![]()
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Natureza dos reagentes
Como citar este documento: MONTEIRO, Wallasse G. Romão. Reações redox. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/ cursinho/home/materias/reacoes-redox.html. Acesso em: [data de acesso].
A quantidade de átomos presentes em cada um dos reagentes influencia a velocidade de uma reação, já que, quanto maior for o número de ligações dos reagentes que precisam ser rompidas para que a reação ocorra e também quanto mais fortes elas forem, mais tempo será gasto para que eles sejam separados (quebra das ligações) para a formação do complexo ativado.
Um exemplo é a destilação fracionada do petróleo. As moléculas com menor número de carbonos são mais fáceis de separar do do que as moléculas mais pesadas - com maior número de carbonos.Eletricidade:
A eletricidade é uma fonte de energia para que a reação ocorra, logo, sob influência de intensidades elétricas maiores, maior a velocidade da reação. A eletricidade atua de forma semelhante à luz, pois ajuda a quebrar a barreira da energia de ativação.
Em uma em um motor de automóvel, por exemplo, a faísca elétrica das velas produz a fonte inicial de calor que dá início à reação.
https://www.stefanelli.eng.br/ciclo-otto-motor-quatro-tempos/
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Lei da velocidade
Como citar este documento: MONTEIRO, Wallasse G. Romão. Reações redox. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/ cursinho/home/materias/reacoes-redox.html. Acesso em: [data de acesso].
Como já mencionado, a concentração dos reagentes e a temperatura são fatores que determinam a velocidade de uma reação química. Esses dois fatores serão importantes para calcularmos a velocidade de uma reação química, utilizando o que chamamos de
, criada em 1864, por dois cientistas Noruegueses,
e
que realizaram importantes estudos na área da cinética química. Além disso, a lei da velocidade também leva em consideração os coeficientes estequiométricos da reação.
Consideremos novamente a equação genérica:
aA+bB → cC+dD
A equação da velocidade é postulado da seguinte forma:
![]()
v = velocidade da reação;
K = constante da velocidade, que depende exclusivamente da temperatura;
[A ou B] = concentração em mol/L de cada reagente;
x ou y = ordem de cada um dos reagentes (a ordem de um participante é a influência que ele exerce na velocidade da reação).
A soma de x + y dá a ordem global da reação.
Reação Elementar
Uma reação elementar, é uma reação que se processa em uma única etapa.
Exemplo: 2CO (g) + O2 (g) → 2CO2 (g)
Aplicando a lei da velocidade para esse caso a ordem dos reagentes são os seus respectivos coeficientes estequiométricos, que no caso do monóxido de Carbono é 2, e no caso do gás oxigênio é 1. Portanto, a equação fica:
v=k.[CO]2.[O2]1
A ordem global dessa reação é a
Reação não - elementar
Uma reação não - elementar é uma reação que se processa em mais de uma etapa.
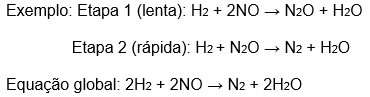
Em problemas deste tipo, para determinar a ordem x e y de cada um dos reagentes, você sempre pega a etapa lenta, porque ela demora mais para acontecer e, portanto, é mais fácil de medir. Dessa forma, a equação fica da seguinte forma:
![]()
Esse método de analisar os coeficientes estequiométricos dos reagentes, na prática nem sempre funciona. Isso reforça a necessidade de se encontrar a equação da velocidade a partir de dados experimentais.
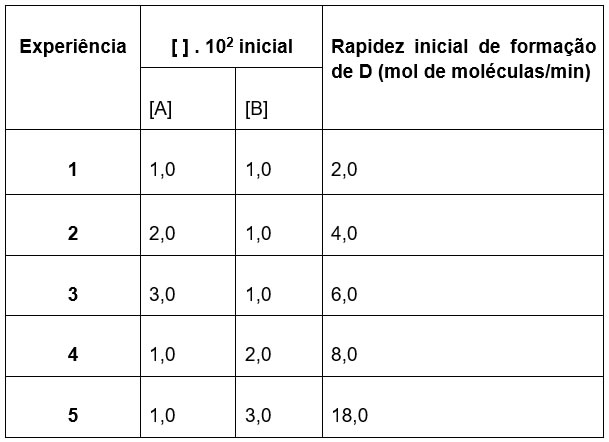
Primeiramente vamos determinar a ordem do reagente A.
Observe os experimentos 1 e 2. Quando eu dobro a quantidade do reagente A e mantenho a mesma quantidade do reagente B, a rapidez da reação ela também dobra, ou seja, a ordem de reação do reagente A é igual a 1.
Agora vamos determinar a ordem do reagente B. Vamos pegar 2 experimentos em que a concentração de A seja inalterada e a concentração de B seja alterada e observar como sua mudança influencia na reação. Pegarei os experimentos 1 e 5. Observe que, ao triplicar a quantidade do reagente B, a velocidade da reação aumenta 9 vezes. Isso indica que a ordem de reação do reagente B é igual a 2.
Dessa forma, a equação da velocidade fica da seguinte forma.
![]()
A ordem global dessa reação é de 3 (basta somar os fatores 1 e 2).
Observe que, se simplesmente tivéssemos aplicado os coeficientes estequiométricos, a equação ficaria ![]() e isso não coincide com a equação obtida a partir dos dados experimentais.
e isso não coincide com a equação obtida a partir dos dados experimentais.
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021
Exercícios
Como citar este documento: MONTEIRO, Wallasse G. Romão. Reações redox. Cursinho Popular IFSP Itapetininga, Itapetininga, fev. 2021. Disponível em: https://cursinhopopular.itp.ifsp.edu.br/site/ cursinho/home/materias/reacoes-redox.html. Acesso em: [data de acesso].
1) (ENEM – 2021) O peróxido de hidrogênio é um produto secundário do metabolismo celular e apresenta algumas funções úteis, mas, quando em excesso, é prejudicial, gerando radicais que são tóxicos para as células. Para se defender, o organismo vivo utiliza a enzima catalase, que decompõe H2O2 em H2O e O2. A energia de reação de decomposição, quando na presença e ausência da catalase, está mostrada no gráfico.
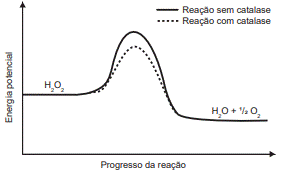
Disponível em: www.pontociencia.org.br . Acesso em: 14 ago. 2013 (adaptado).
Na situação descrita, o organismo utiliza a catalase porque ela
a) diminui a energia de ativação.
b) permite maior rendimento da reação.
c) diminui o valor da entalpia da reação.
d) consome rapidamente o oxigênio do reagente.
e) reage rapidamente com o peróxido de hidrogênio.
2) (ENEM – 2021) A nanotecnologia pode ser caracterizada quando os compostos estão na ordem de milionésimos de milímetros, como na utilização de nanomateriais catalíticos nos processos industriais. O uso desses materiais aumenta a eficiência da produção, consome menos energia e gera menores quantidades de resíduos. O sucesso dessa aplicação tecnológica muitas vezes está relacionado ao aumento da velocidade da reação química envolvida.
O êxito da aplicação dessa tecnologia é por causa da realização de reações químicas que ocorrem em condições de
a) alta pressão.
b) alta temperatura.
c) excesso de reagentes.
d) maior superfície de contato.
e) elevada energia de ativação.
3) (ENEM – 2010) Alguns fatores podem alterar a rapidez das reações químicas. A seguir destacam-se três exemplos no contexto da preparação e da conservação de alimentos:
1. A maioria dos produtos alimentícios se conserva por muito mais tempo quando submetidos à refrigeração. Esse procedimento diminui a rapidez das reações que contribuem para a degradação de certos alimentos.
2. Um procedimento muito comum utilizado em práticas de culinária é o corte dos alimentos para acelerar o seu cozimento, caso não se tenha uma panela de pressão.
3. Na preparação de iogurtes, adicionam-se ao leite bactérias produtoras de enzimas que aceleram as reações envolvendo açúcares e proteínas lácteas.
Com base no texto, quais são os fatores que influenciam a rapidez das transformações químicas relacionadas aos exemplos 1,2 e 3, respectivamente?
a) Temperatura, superfície de contato e concentração.
b) Concentração, superfície de contato e catalisadores.
c) Temperatura, superfície de contato e catalisadores.
d) Superfície de contato, temperatura e concentração.
e) Temperatura, concentração e catalisadores.
4) (ENEM – 2010) A hematita (α-Fe2O3), além de ser utilizada para obtenção do aço, também é utilizada como um catalisador de processos químicos, como na síntese da amônia, importante matéria-prima da indústria agroquímica.
MEDEIROS, M. A. F Química Nova na Escola, São Paulo, v. 32, n. 3, ago. 2010 (adaptado).
O uso da hematita viabiliza economicamente a produção da amônia, porque
a) diminui a rapidez da reação.
b) diminui a energia de ativação da reação.
c) aumenta a variação da entalpia da reação.
d) aumenta a quantidade de produtos formados.
e) aumenta o tempo do processamento da reação.
5) (ENEM – 2010) Há processos industriais que envolvem reações químicas na obtenção de diversos produtos ou bens consumidos pelo homem. Determinadas etapas de obtenção desses produtos empregam catalisadores químicos tradicionais, que têm sido, na medida do possível, substituídos por enzimas.
Em processos industriais, uma das vantagens de se substituírem os catalisadores químicos tradicionais por enzimas decorre do fato de estas serem
a) consumidas durante o processo.
b) compostos orgânicos e biodegradáveis.
c) inespecíficas para os substratos.
d) estáveis em variações de temperatura.
e) substratos nas reações químicas.
6) (UERJ - RJ) A sabedoria popular indica que, para acender uma lareira, devemos utilizar inicialmente lascas de lenha e só depois colocarmos as toras. Em condições reacionais idênticas e utilizando massas iguais de madeira em lascas e em toras, verifica-se que madeira em lascas queima com mais velocidade. O fator determinante, para essa maior velocidade da reação, é o aumento da:
a) pressão
b) temperatura
c) concentração
d) superfície de contato
7) (UFRN- RN) O equilíbrio químico se caracteriza por ser uma dinâmica em nível microscópico. Para se ter uma informação quantitativa da extensão do equilíbrio químico, usa-se a grandeza constante de equilíbrio. Considere a tirinha a seguir:

Aplicada ao equilíbrio químico, a ideia que o personagem tem sobre equilíbrio:
a) É correta, pois, no equilíbrio químico, metade das quantidades sempre é de produtos, e a outra metade é de reagentes.
b) Não é correta, pois, no equilíbrio químico, as concentrações de produtos e as de reagentes podem ser diferentes, mas são constantes.
c) É correta, pois, no equilíbrio químico, as concentrações de reagentes e as de produtos sempre são iguais, desde que o equilíbrio não seja perturbado por um efeito externo.
d) Não é correta, pois, no equilíbrio químico, as concentrações dos produtos sempre são maiores que as dos reagentes, desde que o equilíbrio não seja afetado por um fator externo.
e) É correta, pois, no equilíbrio químico, as concentrações de reagentes e as de produtos sempre não são iguais.
8) (UEMA - MA) Na equação ![]() , após atingir o equilíbrio químico, podemos concluir a constante de equilíbrio
, após atingir o equilíbrio químico, podemos concluir a constante de equilíbrio ![]() , a respeito da qual é correto afirmar que:
, a respeito da qual é correto afirmar que:
a) quanto maior for o valor de Kc, menor será o rendimento da reação direta.
b) Kc independe da temperatura.
c) se as velocidades das reações direta e inversa forem iguais, então Kc = 0.
d) Kc depende das molaridades iniciais dos reagentes.
e) quanto maior for o valor de Kc, maior será a concentração dos produtos.
9) (UFMG) Considere a reação hipotética
A + B ⇄ C + D
Considere também o gráfico da velocidade em
função do tempo dessa reação.
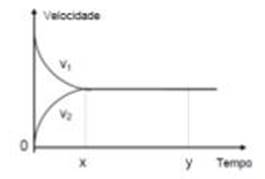
Com base nessas informações, todas as afirmativas
estão corretas, exceto:
a) no instante inicial, a velocidade v1 é máxima.
b) no instante inicial, as concentrações de C e D são nulas.
c) no instante x, as concentrações dos reagentes e produtos são as mesmas.
d) no instante x, a velocidade v2 é máxima.
e) no instante x, as concentrações de A e B são as mesmas que no instante y.
10. (PUC-RS) Mudar a velocidade de uma reação química depende:
I. Do número de colisões entre moléculas na unidade de tempo.
II. Da energia cinética das moléculas que colidem entre si.
III. Da orientação das moléculas na colisão, isto é, da geometria da colisão.
Estão corretas as alternativas:
a) I, II e III.
b) somente I.
c) somente II.
d) somente I e II.
e) somente I e III.
Bibliografia
A CONSTANTE de equilíbrio K. Khan Academy, [s.l.], [20--]. Disponível em: https://pt.khanacademy.org/science/chemistry/chemical-equilibrium/equilibrium-constant/a/the-equilibrium-constant-k. Acesso em: 08 mar. 2021.
CÁLCULO da constante de equilíbrio Kp usando as pressões parciais. Khan Academy, [s.l.], [20--]. Disponível em: https://pt.khanacademy.org/science/chemistry/chemical-equilibrium/equilibrium-constant/a/calculating-equilibrium-constant-kp-using-partial-pressures. Acesso em: 08 mar. 2021.
DIAS, Diogo Lopes. Deslocamento do equilíbrio químico. Brasil Escola, [s.l.], [20--?]. Disponível em: https://brasilescola.uol.com.br/quimica/fatores-que-alteram-equilibrio-quimico.htm. Acesso em: 10 maio 2021.
LISBOA, Julio Cezar Foschini. Química: ensino médio 2º ano. São Paulo: Edições SM, 2012. v. 2. p.114 -203.
Licenciada sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. Cursinho Popular IFSP Itapetininga 2021